结构生物化学/生物物理学 - 单分子技术
单分子技术最近在生物物理学领域变得流行起来,有助于发现或阐明并更好地理解一些重要的生物化学特性,例如蛋白质-DNA相互作用、蛋白质折叠以及膜蛋白的功能和能力。许多单分子技术最初是在物理学和生物物理学领域被发现的,后来被发现对研究生物和生物化学分子有很大的帮助。1976年,首次发现了称为单离子通道记录的技术,随后成为原子力显微镜 (AFM)、光镊和磁镊以及单分子荧光光谱等最新技术的先驱。许多这些最新的技术已帮助蛋白质折叠、转录、复制、翻译、分子马达、膜蛋白和病毒生物学等领域取得了进展。这些单分子方法能够提供以前无法解决的问题的信息,同时也提供了对已研究主题的更详细的了解。不仅如此,单分子技术还能够引导生物化学家摆脱通常的集合平均,从而导致使用摩尔,转向更详细和统一的概念,涉及单个分子和颗粒。
单分子技术的一个有用方面是,它们给出了某个属性值的分布,而不是该属性在大量分子集合中的平均值。这种特性允许获得更完整和具体的数据,这些数据可以比平均值更详细地描述正在评估的特定生物分子,而平均值则提供了相当不具体和广泛的视角。单分子方法的这种特异性还提供了有关分子异质性的信息,分子异质性是复杂生物分子及其功能的一个基本方面。分子异质性可以分为静态和动态两种。静态异质性是指具有多个亚群的分子集合在观察期间非常稳定且不相互转换。一个例子是不活跃的分子。当使用集合方法时,人们试图确定活性分子与整个群体相比的比例。但是,当使用单分子技术时,可以忽略或不考虑非活性分子,因为它们不会产生实验信号。因此,静态异质性允许仅研究感兴趣的物种(活性分子),因为非活性分子可以被忽略和去除。另一方面,动态异质性是指样品中分子亚群在观察期间相互转换。动态异质性的一个例子是一种酶,它在两种催化活性状态之间相互转换,每种构象对底物的亲和力不同。当酶的相互转换速度比所用单分子技术的时态分辨率快时,输出值将显示每种酶两种状态的亲和力的加权时间平均值。另一方面,如果相互转换速度比单分子方法的时态分辨率慢,则可以直接观察到两种状态之间的相互转换。此外,在多步作用于底物的酶中也可以观察到动态异质性,每一步都有不同的速率。通过单分子分析,可以仔细监测酶过程中每个单一步骤的观察结果,作为实时“电影”,显示每个步骤的动力学以及酶和底物的中间结构。
从单分子技术中提取的信息类型也可以与经常使用的集合分析进行比较。一个例子是单分子方法提供的动力学信息。通过单分子方法对反应进行动力学观察提供了所谓的驻留时间。这些驻留时间是指单个分子在反应途径上每个特定状态下的时间。想象一下,通过单分子可观察物观察到名为 A 和 B 的分子的两种结构状态。具有足够时态分辨率来观察这两种状态的单分子方法能够确定状态 A 和 B 的驻留时间。之后,可以绘制频率直方图以提供有关每个驻留时间持续多长时间的信息。驻留时间分布可用于研究酶-底物相互作用。此示例还可以用于揭示单分子技术在其识别生物大分子结构状态的方法中的重要方面。
目前存在各种各样的单分子技术。常用的方法分为两个不同的属性:力学和荧光。这两个组是根据不同的时间分辨率、观察范围和不同的空间分辨率进行分离的。在基于力的检测方法中,有原子力显微镜、光镊、系留颗粒运动和磁镊等特定技术。另一方面,荧光成像包括共聚焦显微镜和全内反射荧光 (TIRF)。
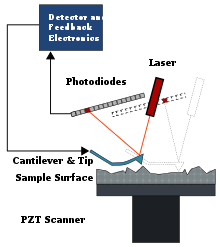
原子力显微镜最初用于平面原子表面上分子的形貌成像。这种成像方式是通过沿着样品表面扫描一个极其尖锐的探针,然后使用激光和象限光电探测器测量探针的偏转来实现的。在这种成像下,可以观察到干燥和湿润的溶液,尽管湿润溶液的时态分辨率远低于干燥溶液。AFM 的设置通常有一个小杠杆(AFM 悬臂梁),该杠杆的一端连接着一个尖锐的纳米级探针,该探针连接到生物分子的其中一端。通过使用压电定位,可以将生物分子吸附的表面在 x、y、z 坐标系(3D 空间)中扫描到埃级分辨率。然后,可以通过使激光束从探针表面反射到位置敏感的光电探测器上,来测量探针的位置。杠杆将充当线性弹簧,当生物分子相对于探针移动时,杠杆将弯曲并在分子上施加力。由于杠杆非常坚硬,因此施加的力可以很大,因此在测量折叠蛋白质和化学键的结构特性方面非常有用。

对于光镊方法,设置涉及一个高功率红外激光,由于高端显微镜物镜,该激光被聚焦得很紧。聚焦的红外激光束将在其焦点处捕获一个微米大小的珠子,这使得能够控制珠子的位置。然后,陷阱就像一个弹簧,当珠子远离激光轴移动时,它会对珠子施加更大的力。通过测量珠子相对于焦点的位移,可以确定陷阱施加的力(这可以使用象限光电探测器完成,就像在 AFM 中一样)。光镊有两种主要模式:恒力模式和恒位模式。当处于恒力模式时,可以通过反馈回路来维持恒定的陷阱力,该反馈回路将移动光学陷阱或样品盖玻片表面,这将使珠子在被捕获区域内保持恒定的位置。在恒位模式下,保持陷阱位置的中心,并且当珠子被拉出陷阱时,它将经历逐渐增大的力。
磁镊的设置将光镊中使用的微珠替换为一个小的磁珠。这个小的磁珠将由靠近样品的磁铁对进行控制。这种设置允许系留的生物分子施加力和轻松施加旋转。磁镊在恒力模式下工作,因为力是感兴趣相互作用的重要控制参数。此外,与光镊相比,磁镊无法获得精细的空间灵敏度。但是,它更容易使用,并且可以与单一生物分子的长期分析兼容。磁镊通常用于研究DNA的结构特性和蛋白质-DNA转录。
此方法用于研究蛋白质和聚合物的相互作用。主要思想是一个珠子结合到表面,而另一个珠子连接到聚合物的末端。然后将它们放入水溶液中,可以看出珠子具有受限的运动,它以布朗运动的方式移动。然后通过光学显微镜记录该珠子的位置;记录可以告诉我们转录过程中DNA的信息。不同的珠子类型也改进了分析聚合物的方法。首先,有时使用金属珠,因为它们具有高强度的金光。其次,聚苯乙烯珠也与光镊结合使用,因为这些珠子比金属珠的强度低。
荧光生物分子包含一些特性,荧光显微镜和光谱学可以使用这些特性来观察它们的位置、结构和动力学。单分子荧光主要有两种方法:共聚焦显微镜用于点检测,宽场成像用于区域检测。共聚焦显微镜用于点检测,试图收集由约1飞升的衍射极限体积发射的荧光。另一方面,对于宽场成像,有全内反射荧光(TIRF)显微镜。TIRF能够通过使用表面上方薄层内的消逝波激发并在表面上方使用超灵敏相机进行成像,长时间观察表面上数百个不动的分子。
FIONA或具有纳米级精度的荧光成像,实现了1纳米的精度运动跟踪。这可以通过连接到目标分子的任何单个荧光团或光散射颗粒(例如,小的金颗粒)来完成。通过这种设置,人们可以识别分子的存在并跟踪其在体外分子轨道上的运动或其在体内的扩散。这种非凡的跟踪能力已经能够揭示驱动蛋白和肌球蛋白等分子马达如何在它们的轨道上移动。这种跟踪精度的结合以及一些探针荧光开关的复杂方法的发现,使得PALM(光激活定位显微镜)和STORM(随机光学重建显微镜)等技术成为可能。PALM和STORM因其能够实现优于50纳米的空间分辨率而被称为“超分辨率显微镜”。
如果将两个探针连接到一个分子上,就会出现一些新的功能。FRET(荧光共振能量转移)与距离相关,可用于测量纳米距离以及单分子内距离的变化。对于FRET,第一个探针将充当FRET供体,而第二个探针将充当FRET受体。第一个探针将是荧光的,第二个探针将以距离依赖的方式猝灭供体(它也可以是荧光的)。由于这种设置,改变供体-受体分离距离的运动也会改变它们的荧光。这些变化用于观察构象变化或分子缔合/解离的动力学。然而,单分子FRET也受荧光团的相对取向和旋转自由度的影响,这可能被误认为是构象变化。可以通过使用MFD(多参数荧光)来检查这种困难,这是一种可以告知单分子荧光特性的方法,例如不同波长下的荧光强度、各向异性和寿命。另一种可以帮助解决复杂问题的方法是ALEX(交替激光激发),它使用两束激光来测量FRET和相对探针化学计量。
单分子研究小组目前正在追求力学和荧光技术的结合,因为它将允许同时操纵和可视化单分子在相互作用和反应时的行为。这种结合之所以有效,是因为力学和荧光技术高度互补,因为基于力的方法可以实现50-100毫秒的时间尺度,而基于荧光的方法可以快得多,并且不受施加力的限制。此外,基于力的方法提供更多关于生物分子全局结构和机械重排的信息,而基于荧光的方法揭示了局部构象变化。这两种单分子方法的互补能力将来可能会带来重大发现。
Kapanidis, A.N. 和 Strick, T.,2009,一次一个分子的生物学,趋势生物化学科学,第 34 卷,第 234-243 页。
