结构生物化学/细胞信号通路/胰岛素信号
胰岛素是由胰腺β细胞在血液中营养物质水平升高时释放的一种激素。胰岛素使肝脏、肌肉和脂肪组织中的细胞从血液中摄取葡萄糖,促进这些营养物质以肝糖原的形式储存在肝脏和肌肉中,并停止使用脂肪作为能量来源。当无法控制胰岛素水平时,会导致糖尿病。1型糖尿病患者的特点是无法体内产生该激素,而2型糖尿病患者则对胰岛素的作用产生抵抗,这可能是由于无法控制血糖水平造成的。作为一种肽类激素,胰岛素由 51 个氨基酸组成,分子量为 5808Da。胰岛素在胰腺的胰岛中产生,其名称来源于拉丁语 insula,意为“岛屿”。

胰岛素的受体是跨越细胞膜的两个相同亚基的二聚体。每个亚基由一个α链和一个β链组成,通过单个二硫键连接在一起。α链位于细胞膜的外侧,而β链跨越细胞膜,只有一个片段,除该片段外,位于细胞膜的内侧。[1]
当检测到胰岛素时,细胞外部的两个α链会移动在一起,并围绕胰岛素折叠。该动作将β链移动在一起,从而使β链成为一个活跃的酪氨酸激酶。酪氨酸激酶催化磷酸基团从 ATP 转移到β链激活环中的酪氨酸。磷酸化的激活环随后会发生巨大的构象变化,导致激酶完全激活。[2]
胰岛素受体底物是一组特殊的蛋白质,它们被吸引到激活的胰岛素受体上的磷酸化位点。这些位点充当 IRS 蛋白的对接点。每个 IRS 分子都有四个序列,这些序列近似为 Tyr-X-X-Met。这种重复出现的序列是 IRS 分子对受体酪氨酸激酶的亲和力的原因。然后,酪氨酸激酶会磷酸化这些酪氨酸,导致 IRS 分子激活。激活的 IRS 蛋白充当衔接蛋白。衔接蛋白将激酶与其底物结合在一起,而不是激活激酶。例如,激活的 IRS 蛋白结合到脂类激酶,从而将脂类激酶吸引到脂类膜,即其底物。[3]
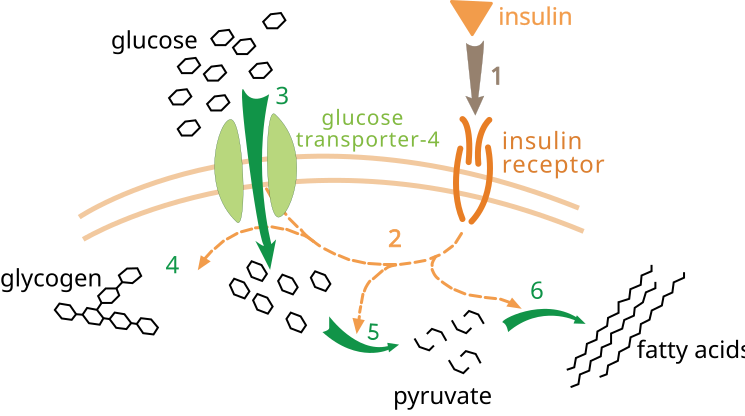
SH2 是存在于许多信号转导蛋白中的一个结构域。SH2 结构域是特定磷酸酪氨酸序列的宿主,例如激活的 IRS 蛋白中的那些序列。这是一个特定过程,因此每个 SH2 结构域都对包括磷酸酪氨酸的近似序列具有结合偏好。一大类脂类激酶具有被吸引到 IRS 蛋白的 SH2 结构域。这些脂类激酶在磷脂酰肌醇 4,5-二磷酸 (PIP2) 中的肌醇的 3 位反应,并添加一个磷酸基团。通过将脂类激酶吸引到 IRS 蛋白,反应将激酶移动到位于膜上的 PIP2,在那里它可以将它们磷酸化为磷脂酰肌醇 3,4,5-三磷酸 (PIP3)。这会导致级联反应,激活蛋白激酶 PDK1,PDK1 磷酸化蛋白激酶 Akt,从而也激活它。Akt 是细胞质中一个自由移动的激酶,它在细胞内磷酸化靶标,例如控制 GLUT4(一种葡萄糖转运蛋白)移动的蛋白质,将其带到细胞表面。这只是许多以胰岛素受体激活 IRS 为起点通路的其中之一。[4]
胰岛素受体的磷酸化启动了一系列蛋白质的丝氨酸-苏氨酸磷酸化。它们与 3 个额外的蛋白激酶信号系统相连。蛋白激酶信号系统包括:1) 通过 PI3-激酶和磷脂酰肌醇 (3,4,5)P3(PI-3 激酶和蛋白激酶 B/Akt)进行信号传导的通路,2) 丝裂原活化蛋白激酶 (MAPKinases),3) 可能通过未与 IRS 蛋白偶联的激酶进行的相互作用。
•葡萄糖储存和摄取
胰岛素与 a 亚基结合,并改变构象,导致酪氨酸残基的自磷酸化。这些残基随后被磷酸酪氨酸结合域(称为 PTB)识别,例如胰岛素受体底物、SHC 和 Cbl。激活的受体磷酸化受体上的酪氨酸残基。这些受体通过其 SH2 域与信号分子相互作用,并激活许多其他通路,例如 PI 3-激酶信号通路、MAPK 激活和 Cbl/CAP 复合物激活。这些通路的结果是调节葡萄糖、脂类和蛋白质代谢。
•蛋白质合成
胰岛素刺激氨基酸进入细胞的摄取,阻止蛋白质降解并促进蛋白质合成。
•脂类合成调节
胰岛素刺激脂肪酸的摄取和脂类合成,并抑制脂解。脂类合成需要大量的转录因子类固醇调节元件结合蛋白 (SERBP)-1c。胰岛素通过激活脂肪细胞中的 cAMP 特异性磷酸二酯酶来降低 cAMP 浓度,从而抑制脂解、脂类代谢。
•有丝分裂反应
胰岛素受体的另一个底物是 SHC。SHC 的磷酸化与 GRB2 有关,GRB2 可以独立于胰岛素受体底物激活 MAPK 通路。其他信号转导蛋白与 GRB2(一种含有 SH3 结构域的胰岛素受体底物)相互作用,该结构域与鸟嘌呤核苷酸交换因子 son-of sevenless 有关,并促进 MAPK 通路的激活,然后达到有丝分裂反应。
- ↑ Berg, Jeremy (2007). 生物化学,第 6 版. 纽约,纽约:萨拉·特尼。第 392-393 页。 ISBN 978-0-7167-8724-2.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Berg,Jeremy (2007)。生物化学,第 6 版。纽约,纽约:Sara Tenney。第 392–393 页。ISBN 978-0-7167-8724-2.
{{cite book}}: 未知参数|coauthors=被忽略 (|author=建议) (帮助) - ↑ Berg,Jeremy (2007)。生物化学,第 6 版。纽约,纽约:Sara Tenney。第 393–394 页。ISBN 978-0-7167-8724-2.
{{cite book}}: 未知参数|coauthors=被忽略 (|author=建议) (帮助) - ↑ Berg,Jeremy (2007)。生物化学,第 6 版。纽约,纽约:Sara Tenney。第 394–395 页。ISBN 978-0-7167-8724-2.
{{cite book}}: 未知参数|coauthors=被忽略 (|author=建议) (帮助)
http://www.abcam.com/index.html?pageconfig=resource&rid=10602&pid=7