结构生物化学/细胞信号通路/蛋白激酶信号级联
蛋白激酶不是可以磷酸化其他蛋白以赋予蛋白编码的酶。这些编码指示细胞执行工作,例如分裂或生长。磷酸化是激活或失活酶的常见方法,因此蛋白激酶通常存在于信号通路中。高达 30% 的所有人类蛋白都通过磷酸化修饰,这使得激酶在细胞调节中极其重要。由于一个激酶分子可以作用于许多蛋白,因此激活激酶的效果会放大目标蛋白激活的数量。如果激酶作为信号通路的一部分作用于另一个激酶,则激活激酶的效果会放大数倍,从而导致信号级联。级联可以通过蛋白磷酸酶移除磷酸基团来停止[1]。
在生活中可以看到一个信号级联的例子,它重塑细胞外基质,导致肿瘤细胞干预。肝素酶添加到信号级联中,导致特定蛋白激酶的磷酸化增加,并由于基因转录增加而产生肿瘤。
激酶和磷酸酶都受复杂信号通路的调节。信号级联开始时激酶的激活可以来自几个来源,包括环状腺苷单磷酸(cAMP)和钙调蛋白。cAMP 的释放是由肾上腺素等激素激活的。
-
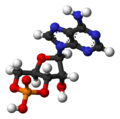
环状腺苷单磷酸
-
环状腺苷单磷酸
-
钙调蛋白 3D 结构
例如:cAMP 与 PKA(蛋白激酶 A)的调节亚基结合会解除其对催化亚基的抑制。简而言之,cAMP 激活激酶。
激酶通常通过将 ATP 分子与待修饰的蛋白在疏水口袋中结合在一起,以排除水。然后将磷酸基团从 ATP 转移到待激活蛋白上的氨基酸。磷酸化通常发生在丝氨酸的羟基、苏氨酸或酪氨酸上,但也有一些激酶作用于其他氨基酸,例如组氨酸、天冬氨酸和谷氨酰胺。在信号级联中,新激活的蛋白也可能是一种激酶,然后可以磷酸化其他蛋白。
磷酸基团的结合可以通过两种方式影响蛋白的活性。磷酸化可以通过引起蛋白构象变化来直接影响活性。或者,磷酸化的氨基酸可以被特定蛋白或其他底物识别并结合[2]。羧基末端包含一个磷酸酪氨酸残基,它可以与 SH2 结构域接触。此外,SH2 结构域和激酶结构域由 SH3 结构域结合。在这种情况下,激酶处于其非活性构象。该蛋白可以通过三个基本步骤激活:1. 与 SH2 口袋结合的磷酸酪氨酸残基可以被具有更高亲和力的多肽取代,该多肽对该 SH2 结构域具有更高亲和力。2. 在酪氨酸中,磷酸基团可以被磷酸酶去除,最后 3. 连接体可以被具有更高亲和力的多肽从 SH3 结构域中取代。
已经被蛋白激酶磷酸化的蛋白可以通过蛋白磷酸酶去磷酸化。磷酸酶引入水以水解磷酸二酯键,释放去磷酸化蛋白和正磷酸。当初始触发信号分子消失时,例如当激素被分解时,整个信号级联停止。一些级联是自终止的,因为激活的激酶会磷酸化催化触发分子分解的酶,例如 cAMP 的情况。
由于激酶可以迅速导致细胞发生非常大的变化,因为信号被放大,所以它们的活性受到严格的调节。许多激酶本身受磷酸化的控制,一些激酶会自身磷酸化,这个过程称为顺式磷酸化或自磷酸化。激酶调节的其他方法包括抑制蛋白或激活蛋白或小分子的结合,以及控制它们在细胞内的位置。
有丝分裂原活化蛋白激酶(或 MAP 激酶)众所周知在使卵母细胞保持停滞状态直到受精中发挥重要作用。科学家认为 MAP 激酶信号传导是细胞间通信流中非常重要的一个。在哺乳动物卵子中,卵子在减数分裂的第二次中期停止,活性 MAP 激酶会阻止卵子在受精后完成减数分裂。与其他蛋白激酶一样,它将磷酸基团从 ATP 转移到受体蛋白上的丝氨酸、苏氨酸或酪氨酸氨基酸上。这种磷酸化会改变其靶蛋白的活性和功能。MAP 激酶会磷酸化多种胞质蛋白和转录因子,这些蛋白和转录因子会执行酶的下游效应。MAP 激酶受另一种称为 MEK 的蛋白激酶的调节,MEK 会特异性地磷酸化 MAP 激酶氨基酸链中的 Thr 202 和 Tyr 204,并开启 MAP 激酶的蛋白激酶活性。MAP 激酶的其他功能包括指示未成熟细胞如何成长为专门的细胞类型或如何死亡。由于它们是许多重要细胞过程的关键,许多研究人员希望将它们用作药物的良好靶点。
显然,MAP 激酶对环境平衡的几乎任何变化都会被激活,其调节对维持机体的健康至关重要。MAP 激酶信号传导错误会导致代谢综合征和 2 型糖尿病等并发症。代谢综合征是用来描述代谢过程中各种干扰的副作用的术语,例如胰岛素抵抗和肥胖。
应激激活蛋白激酶 (SAPK) 信号通路负责调节细胞对环境变化的反应,例如发育、转化、炎症和物理应激。SAPK 通路与 MAPK 通路相似,因为它们具有共同的特征,例如底物特异性和双重磷酸化。SAPK 信号通路的调节不当可能会导致心血管疾病等并发症。