结构生物化学/化学键/共价键

共价键是由相邻原子之间共享价电子形成的化学键。这种类型的键合主要出现在非金属的相互作用中。共价键使元素能够与其他分子和原子形成多个键,这是形成大分子所必需的。在共价键中,随着原子核之间距离的减小,每个原子核开始吸引另一个原子的电子,从而降低了系统的势能。然而,当吸引力增加时,原子核之间以及电子之间的排斥力也随之增加。在共价键中,每个原子都实现了完整的外部(价)电子层。共价键中的每个原子都将共享的电子视为完全属于自己。大多数共价物质的电导率很低,因为电子是局域化的,并且不存在离子。总的来说,共价键中的原子会振动,这些振动的能量可以用红外光谱进行研究。
观察共价键时,需要遵循的一般规则是八隅体规则,也称为惰性气体构型。参与共价键的原子(除少数例外)必须遵循八隅体规则,该规则指出原子周围必须有八个电子。这些电子可以是共享的或非共享的。这两个原子不需要平等地共享它们的电子;可以从一个原子捐赠电子对,而不是每个原子都捐赠一个电子。可以使用元素周期表来确定原子中价电子的数量。一般规则是,如果所有原子周围有八个电子,它们将是稳定的。因此,不同的原子可以与其他具有未配对电子的原子共享其未配对电子以获得八隅体。
这个规则有一些例外。两个非常重要的例外是氢 (H) 和氦 (He)。这些原子没有八隅体,只需要总共两个电子才能稳定。这是因为氢和氦只包含一个 1s 电子层,该电子层只能容纳两个电子。其他例外发生在分子或两个分子之间总电子数为奇数时。这些分子往往非常活泼。此外,周期表中第二行之后的原子周围可以有超过八个电子。 [1] 例如,在五氟化磷 (PF5) 中,磷与 10 个电子键合,而在六氟化硫 (SF6) 中,硫原子与 12 个电子键合。分子也可能缺电子,这意味着没有足够的可用电子来完成分子中所有原子的八隅体。硼三氯化物 (BCl3) 就是一个缺电子的分子。在这个分子中,硼原子只与三个电子对键合,而氯原子周围是完整的八隅体。 [2]
原子之间可以形成多个共价键,这些键比单键更强,具有更高的键能和更短的键长。键级用于确定共价键中电子对的数量。当分子具有双键和单共价键时,它可以具有能量相同的不同化学形式作为共振结构,这具有更高的稳定性,并且键是双键和单共价键的平均值。共价键的特性也会受到它连接的两个原子的影响。

单键是较弱的共价键类型之一。单共价键也称为 σ 键。当仅共享两个电子时,就会形成它们。这会导致轨道重叠和电子密度云的合并。单键往往非常灵活,允许原子绕键旋转。碳-碳 (C-C) 共价键就是一个单键的例子,其键长为 1.54 埃,键能为 356 kJ/mol。
请注意,单键的性质不仅取决于它连接的两个原子,还取决于这些原子周围的原子。 σ 键没有节点平面。
一些共价单键也具有双键性质,它们更短、更硬且不可旋转。一个例子是蛋白质中的肽键,它将每个氨基酸连接在一起形成多肽。肽键为 1.32 埃,短于 1.54 埃 (C-C)。断裂肽键所需的能量远高于单键,并且这种不可旋转的单键有助于多肽链的平面性质,这也使肽键比正常的单键更稳定。双键性质是由肽键的共振结构贡献的。
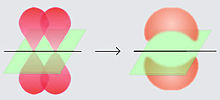
当共价键包含四个共享电子时,就会发生双键。双共价键包含一个 σ 键和一个 π 键。π 键适用于重叠的 p 轨道。轨道只能以侧对侧的方式重叠,从而导致在核间轴上有一个节点平面。单共价键只包含一个 σ 键。双键往往比其单键等效物更短且更强。双键还在键周围产生电子密度。与单键不同,双键不灵活,两个相邻的原子不能绕键旋转。

三共价键包含一个 σ 键和两个 π 键,其中共享了六个电子。这些键比双键更强,也更短。它们比双键更硬,并且具有更大的电子密度。最常见的三键是在碳上,如 C2H2。绘制三键的骨架形式是将三个直线连接两个原子。
共价键可以根据键合在一起的原子的电负性值分为极性和非极性。如果两个原子电负性值之间存在很大差异,就会形成极性共价键。原子不需要具有相同的电负性值或属于相同的元素,但它们需要在数值上相对接近。如果电负性值越接近,原子之间的共价键就越强。该规则的例外情况是当分子具有对称性时。当总偶极矩为零时,例如 CO2 的线性分子,该分子被认为是非极性的。电负性更大的原子会吸引电子,使自身带部分负电荷,并使另一个原子带部分正电荷。这些部分负电荷和正电荷是偶极-偶极相互作用、偶极-诱导偶极相互作用和诱导偶极-诱导偶极相互作用的原因。这种吸引力-排斥力稳定性赋予共价键稳定性。除了原子之间的电负性差异外,共价键还取决于相邻原子彼此之间的角度。[3]
确定键类型的典型公认值
电负性差异 - X < 0.5 - 非极性共价键
电负性差异 - 0.5 ≤ X ≤ 1.9 - 极性共价键
电负性差异 - 1.9 < X - 离子键
共价键的特定类型
[edit | edit source]二硫键在化学相互作用中,某些化合物可以反应形成二硫键,这是一种通常由两个硫醇 (-S-H) 偶联产生的共价键。这些相互作用也可以称为SS-键或二硫键,这些相互作用的连接主要是 R-S-S-R。
蛋白质折叠中的作用二硫键在蛋白质的第三级结构中起着至关重要的作用,它们对蛋白质折叠和稳定性有影响。蛋白质之间的这些二硫键通常在半胱氨酸残基的硫醇基团之间形成。另一个含有硫的氨基酸是蛋氨酸,它不能形成二硫键。

二硫键通过多种方式帮助稳定蛋白质分子的三级结构,例如,二硫键通过降低其总熵或状态或混乱度来使蛋白质的未折叠形式不稳定。此外,当二硫键连接蛋白质链的两个片段时,这会增加蛋白质残基的有效局部浓度并降低特定区域中水的效应。由于已知水分子会攻击酰胺-酰胺键,因此降低这些二硫键区域中水的效应有助于稳定蛋白质。
共价键:键长和键能
[edit | edit source]键能 (BE) 是原子之间吸引或断裂所需的能量。由于它是断裂原子之间吸引力所需的能量,因此键能是吸热的,并且为正值。但是,形成键所需的能量是放热的,并且为负值。键长是两个共价键合原子的原子核之间的距离。它可以根据键合原子的总半径计算。因此,当共价半径增加时,键长也会增加。键长越短,断裂原子之间吸引力所需的键能就越高,因为原子之间的距离越短意味着键将更强,更难断裂。另一方面,键长越长,断裂较弱键所需的键能越低。可以使用键能来确定 ΔHrxn。在反应中,当两个原子彼此反应形成不同原子的产物时,存在两种类型的键能。一种是反应物断裂所需的能量,另一种是产物形成所需的能量。因此,两种键能之差是反应的焓或功。ΔH0rxn= ΔH反应物键断裂 + ΔH产物键形成[4]
参考文献
[edit | edit source]- ↑ Vollhardt 和 Shore 的有机化学
- ↑ http://chemed.chem.wisc.edu/chempaths/GenChem-Textbook/Exceptions-to-the-Octet-Rule-573.html
- ↑ Berg, Jeremy; Tymoczko, John; Stryer, Lubert. 生化,第 6 版。W.H. Freeman and Company. 2007. (7)
- ↑ Silberberg, Martin S. (2010)。普通化学原理(第 2 版)。麦格劳-希尔出版公司。ISBN978-0-07-351108-05
Silberberg, Martin S. 化学“物质和变化的分子性质”。第五版。
