结构生物化学/化学键/二硫键
二硫键,也称为S-S键或二硫桥,是由两个硫醇基团衍生而来的共价键。在生物化学中,术语R-S-S-R连接通常用于描述整体连接。创建这种键的最常见方法是通过硫醇基团的氧化。(2 RSH → RS-SR + 2 H+ + 2 e-)这种氧化过程可以产生稳定的蛋白质二聚体、聚合物或复合物,其中硫化物键可以帮助蛋白质折叠。这个过程主要发生在半胱氨酸的硫醇基团。[1]
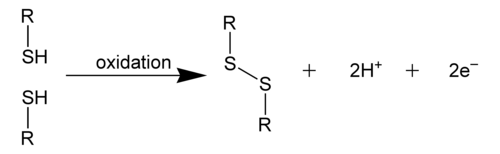
二硫键可以以两种方式出现:分子内和分子间。分子间二硫键发生在多肽链之间,而分子内二硫键发生在多肽链内,通常负责稳定蛋白质的三级结构。另一方面,分子间二硫键被认为是稳定蛋白质四级结构的因素。[1]

蛋白质膜中的二硫键存在于细菌和真核生物中。胞外蛋白通常具有多个二硫键,而胞内蛋白通常缺乏二硫键。在蛋白质中,这些键形成于两个半胱氨酸氨基酸的硫醇基团之间。多个线性多肽链之间的交联在蛋白质中并不罕见。大多数交联来自两个半胱氨酸氨基酸氧化形成的二硫键。结果是将多肽链连接起来的称为胱氨酸的二硫键。半胱氨酸氨基酸基团是唯一能够形成二硫键的氨基酸,因此只能与其他半胱氨酸基团形成二硫键。这些键负责稳定球状结构,是蛋白质可以拥有的最强的键类型之一,是将蛋白质保持在其各自构象中的主要力量之一,因此在蛋白质折叠和稳定性中起着重要作用。
二硫键的典型键解离能为 60 kcal/mol,键长为 2.05 Å。产生围绕 S-S 键旋转所需的能量相当低,因此这些旋转很常见。在接近 90° 的二面角处,键往往更稳定。但是,在接近 0° 和 180° 的角度处,键变得明显更好的氧化剂。二硫键已在 E. Coli 的蛋白质折叠中被发现。它们用于许多过程,包括 DNA 复制。
大多数环状肽键是在二硫键之间形成的。因此,环状肽的变性通常可以归因于二硫键的稳定性。在肽 1(cyclo(1,4)-Cys-Gly-Phe-Cys-Gly-OH)的研究中,它在 pH 1-11 的缓冲溶液中于 70 摄氏度下进行。发现最大的稳定性来自 pH ~ 3 和 pH ~1-~5 之间的 V 形。随着 pH 从中性变为碱性,在 Gly2-Phe3 之间发现了降解,这是由于二硫键的断裂造成的。

制造二硫键的多种方法
在 Neil J. Bulleid 和 Lars Ellgaard 的期刊文章“制造二硫键的多种方法”中,他们讨论了二硫键如何在内质网 (ER) 中形成,以及催化形成途径的不同酶。二硫键增加了蛋白质的稳定性,还“调节氧化还原依赖性功能”,多年来,我们对蛋白质中二硫键是如何形成的认识发生了巨大变化。[2]
二硫键是在蛋白质二硫键异构酶 (PDI) 家族中的酶存在下产生的。它们充当氧化剂,氧化蛋白质上的硫醇基团。如果蛋白质的氨基酸残基,特别是半胱氨酸,彼此靠近,即使它们没有正确折叠,它们也会形成二硫键。如果在蛋白质没有正确折叠时形成二硫键,他们称之为非天然二硫键。这可能是错误折叠的蛋白质,也可能是蛋白质折叠成天然状态之前的中间体之一。PDI 通过充当异构化过程的催化剂来帮助非天然二硫键变成天然二硫键(它们必须帮助破坏非天然二硫键,以便蛋白质能够在形成天然二硫键之前正确完成折叠)(图 1)。[2]
Ero1
Bulleid 和 Ellgaard 研究了酵母中的一种酶,以了解二硫键是如何从头(拉丁语意为“在开始时”)形成的。他们研究的酶是内质网氧化还原酶 (Ero1p)。实验表明,“Ero1p 和哺乳动物同源物 ERO1(alpha) 和 ERO1(beta) 能够通过将从头二硫键形成与氧气还原为过氧化氢 (H2O2) 偶联来催化氧化。” Ero1p 被证明可以氧化 PDI,这使 PDI 能够交换蛋白质上的二硫键。使用敲除实验,他们能够证明,虽然在酵母中,Erop1 的敲除会中断二硫键的形成,但在高等真核生物(例如,小鼠和人类)中,ERO1(beta) 的敲除只会导致胰岛素原的错误折叠,而 ERO1(alpha) 和 ERO1(beta) 的双敲除不会比 ERO1(beta) 的单敲除更糟糕。事实上,一段时间后,“双敲除细胞在强还原性挑战后重新建立了正常的内质网氧化还原条件,尽管速度比野生型细胞慢。” 这告诉我们,ERO1 在高等真核生物中不像在酵母中那么必要,这意味着还有其他形成二硫键的途径。[2]
PRDX4
由于通过 ERO1 催化形成二硫键时会产生过氧化氢,而 H2O2 会造成生物分子的损伤,因此 Bulleid 和 Ellgaard 认为必须有其他蛋白质才能去除 H2O¬2¬。这就是过氧化还原蛋白 (PRDX4) 的作用所在。PRDX4 是一组位于内质网中的酶,它们既能去除 H2O2,又能形成二硫键。在这个过程中,PRDX4 中的过氧化酶半胱氨酸从 H2O2 中获取一个氧原子生成水和一个 –SOH 基团,然后它与相邻的 –SH 基团反应形成二硫键(图 2)。现在,它可以与一些 PDI 蛋白上的 –SH 基团交换,以便它可以与底物蛋白交换(图 1)。[2]
1. He, HT. "模型环状五肽中二硫键的合成和化学稳定性:cyclo(1,4)-Cys-Gly-Phe-Cys-Gly-OH。"堪萨斯大学,堪萨斯州劳伦斯 66047,美国。
2. Neil J. Bulleid,Lars Ellgaard,制造二硫键的多种方法,生物化学趋势,第 36 卷,第 9 期,2011 年 9 月,第 485-492 页,ISSN 0968-0004,10.1016/j.tibs.2011.05.004。(http://www.sciencedirect.com/science/article/pii/S096800041100082X)
