结构生物化学/趋化性
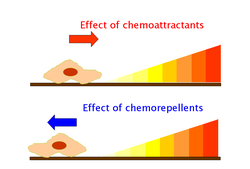
趋化性是对化学刺激的趋向性反应,生物体要么向刺激移动,要么远离刺激。导致生物体靠近它的化学物质称为吸引剂,而导致生物体远离它的化学物质称为驱避剂。
细胞使用鞭毛马达来移动,要么朝向吸引剂移动,要么远离吸引剂移动。当细胞远离吸引剂时,受体发出信号,使一个或多个鞭毛的旋转方向从逆时针 (CCW) 切换到顺时针 (CW)。当旋转开关以逆时针方向旋转时,细胞会朝一个方向运行,通常朝向吸引剂,这是有利的。当鞭毛马达以顺时针方向旋转时,鞭毛会破坏运行,导致细胞翻滚。每次翻滚都会使细胞向一个新的方向游动。逆时针旋转使细胞比细胞翻滚时移动得更快。
由交替的游泳和翻滚产生的运动模式是“有偏见的随机游走”,其中细胞有时随机移动,但总体上趋向于迁移到吸引剂处。当没有吸引剂存在时,运动会导致“随机游走”,翻滚次数更多。

从细菌中分离和纯化完整的鞭毛,例如大肠杆菌。然后通过电子显微镜确定大肠杆菌的结构。正是利用这些数据,才能理解鞭毛的结构和功能。对细菌鞭毛运动的进一步研究表明,有几种基因是进行趋化性所必需的,称为che 基因。Jerry Hazelbaur 和 Bob Mesibov 发现了不能对单一吸引剂进行趋化性的突变体,并将其称为“特异性非趋化性突变体”(Adler 2011)。这些突变体后来用于测试以确定哪些化学物质是吸引剂,哪些是驱避剂。
运动细菌对环境线索做出反应,以移动到更合适的位置。介导这些反应的趋化性信号转导系统的组成部分在原核生物中高度保守,包括真细菌和古细菌物种。研究得最透彻的系统是在大肠杆菌中发现的。吸引剂和驱避剂化学物质通过与跨膜趋化受体蛋白的相互作用而被感知,这些受体蛋白与一个或两个细胞极上的多聚体组装体一起定位,以及组氨酸蛋白激酶 CheA、SH3 样衔接蛋白 CheW 和磷蛋白磷酸酶 CheZ。这些多聚体蛋白组装体控制响应调节剂 CheY 的磷酸化水平,CheY 指示鞭毛运动。细菌趋化性是最容易理解的信号转导系统之一,该系统的许多生化和结构细节已被阐明。这是一个令人兴奋的研究领域,因为现在的知识深度使得能够研究跨膜信号传导和信号处理的详细分子机制。
John Armstrong 与大肠杆菌一起研究,发现了第一个非趋化性突变体。这些突变体基本上是不表现出对化学刺激的任何吸引或驱避反应的细菌。但是,细菌仍然是运动的。通过进一步分析,发现三个 che 基因是大肠杆菌进行趋化性所必需的。这些 che 基因是 cheA、cheB 和 cheC。Jerry Hazelbauer 和 Bob Mesibov 在另一项研究中对 che 突变体进行了进一步研究,这导致了趋化吸引剂和趋化驱避剂的发现。
Che 基因负责趋化过程中的 Che 蛋白,Che 蛋白紧随接收化学刺激的 MCP(甲基化接受趋化蛋白)受体,在鞭毛之前。Che 蛋白执行“激发”和“适应”过程。发现了另外四个 che 基因 (cheW、cheY、cheZ 和 cheR),这些基因在细菌趋化性中发挥着重要作用。在 MCP 受体接收吸引剂或驱避剂刺激后,cheA、cheW、cheY 和 cheZ 向鞭毛发出信号以执行激发,cheB 和 cheR 向鞭毛发出信号以执行适应。这些 che 基因常见于细菌(使用鞭毛进行移动的细菌和使用菌毛进行移动的细菌)和古细菌中。(Adler 2011)
携带运动性 (mot) 和趋化性 (che) 基因的杂合大肠杆菌 ColE1 质粒被转移到一个微细胞产生菌株。杂合质粒上的 mot 和 che 基因指导微细胞中的蛋白质合成。在微细胞中合成的多肽与先前使用杂合λ和紫外线照射宿主细胞鉴定出的 motA、motB、cheA、cheW、cheM、cheX、cheB、cheY 和 cheZ 基因的产物相同 (Silverman 和 Simon, J. Bacteriol. 130:1317-1325, 1977),从而证实了这些基因产物的分配。一些 che 基因 (cheA 和 cheM) 的产物在聚丙烯酰胺凝胶电泳上表现为多个条带,但对这些多肽部分肽消化分析表明,这些多种形式是由单个基因编码的。测量杂合质粒的物理长度,可以估算出克隆的脱氧核糖核酸中用于合成 mot 和 che 基因产物的编码能力。这些估计值也与 cheA 和 cheM 的多个多肽是单个基因的产物的假设一致。
大肠杆菌中三个趋化性特异基因 cheM、cheD 和 cheZ 的产物被甲基化。cheZ 基因编码合成一种 24,000 分子量的多肽,该多肽出现在细胞质中。cheM 编码合成一种 61,000 分子量的膜结合多肽。cheD 编码合成另一种 64,000 分子量的膜结合多肽。CheM- 突变体表现出对某些吸引剂的趋化性 (Tar- 表型),而 CheD- 突变体对其他吸引剂做出反应 (Tsr- 表型)。双突变体 (CheD-、CheM-) 不对任何测试的吸引剂或驱避剂做出反应。因此,这些多肽在趋化性中起着核心作用。它们收集来自两个趋化受体子集的信息,并作为趋化受体途径的最后一步以及将信号传输到鞭毛转子的普遍信号处理的第一步。建议它们可能参与反映趋化受体瞬时状态的初始过程以及整合性适应过程。另外两个基因 cheX 和 cheW 是 cheD 和 cheM 基因产物甲基化所必需的。
Bob Mesibov 对大肠杆菌进行了针对 53 种氨基酸和相关化学物质的吸引性测试。这是通过使用在 L-丝氨酸和 L-天冬氨酸中反应无关的突变体来完成的。Jerry Hazelbauer 和 Marge Dahl 还测试了大肠杆菌对 85 种常见糖和相关化学物质的吸引性。此类别中测试的吸引性最高的有:D-半乳糖、D-葡萄糖、D-甘露醇、D-核糖、D-山梨醇、麦芽糖和海藻糖。Wolfgang Epstein 和 Julius Adler 后来进行的一项研究表明,磷酸转移酶糖也是吸引剂。还发现一些无机盐是吸引剂。(Adler 2011)
白细胞迁移的研究继续为二级淋巴器官中淋巴细胞启动的调节和炎症组织中的效应反应提供新的见解。趋化因子受体一直被认为是细胞进入组织的促进剂。随着鞘氨醇-1-磷酸受体的发现,这一整体概念现在必须进行修订,鞘氨醇-1-磷酸受体控制细胞从淋巴组织的退出。调节淋巴组织归巢的趋化因子通常与调节白细胞募集到炎症组织的趋化因子不同。然而,有证据表明淋巴结中白细胞募集的炎症途径,以及外周组织中组成型途径。最后,趋化因子受体及其信号通路的拮抗剂(或激动剂)代表了治疗多种炎症性疾病(包括过敏)的最有吸引力的策略。
对趋化驱避剂的测试方式与对趋化吸引剂的测试方式类似。对于大肠杆菌,Wung-Wai Tao 测试了 164 种不同的化学物质。这些测试的结果表明,最有效的驱避剂是:短链脂肪酸、疏水性氨基酸、苯甲酸盐、吲哚、粪臭素、水杨酸盐以及离子 Co2+、Ni2+、H+ 和 OH-。(Adler 2011)
虽然草履虫已被广泛用作模型感觉细胞来研究对热、机械和趋化性刺激的细胞反应,但对其对趋避物的反应知之甚少。一项方便的毛细管趋避物生物测定法描述了四种对草履虫具有趋避性的化合物,并将其反应与四膜虫的反应进行了比较。经典的草履虫 T 型迷宫趋化性测试也用于验证这是一种可靠的趋避物测定法。前两种化合物,GTP 和氧化剂 NBT,已知在草履虫中是去极化趋避物,但这首次报道了它们在四膜虫中作为趋避物。后两种化合物,分泌促进剂 Alcian 蓝和染料 Cibacron 蓝,以前从未在这些纤毛虫中被描述为趋避物。另外两种化合物,分泌促进剂 AED 和氧化剂细胞色素 c,被发现对草履虫具有趋避性,但对四膜虫则没有。这些化合物的趋避性与其毒性无关。原因是因为细胞在所有这些化合物中都完全存活。更重要的是,所有这些趋避物在微摩尔到纳摩尔浓度下都是有效的,这为在未来关于其膜受体和可能的受体操作离子通道的研究中将它们用作兴奋性配体提供了机会。
双组分系统
[edit | edit source]双组分系统由不参与趋化性的 che 蛋白构成。相反,这些 che 基因与细胞中的转录调节因子关系更为密切。在双组分系统中发生一个重要现象,它影响细菌鞭毛的旋转和运动。当第一个组分的组氨酸残基被 ATP 磷酸化时,磷酸被转移到第二个组分的门冬氨酸残基,这会影响鞭毛的旋转和运动。双组分系统中的磷酸化也控制着蛋白质合成所需的基因。双组分系统主要存在于细菌、古细菌和单细胞真核生物中。趋避物引起 cheA 和 cheY 的磷酸化。因此,这会导致细菌鞭毛的翻滚。这使得细菌能够远离趋避物。趋化物阻止 cheA 和 cheY 的磷酸化,因此翻滚停止。另一方面,这使得细菌能够朝向趋化物奔跑。细菌与趋避物和趋化物的相互作用被称为激发。激发决定了细菌的运动。适应,继激发之后的过程,决定了细菌的旋转。趋避物导致甲基化的 MCP(甲基接受趋化性蛋白)的去甲基化,而趋化物导致其甲基化。一般来说,趋避物会导致细菌以顺时针方向旋转,而趋化物会导致细菌以逆时针方向旋转。http://www.pnas.org/content/94/14/7263/F1.expansion.html (Adler 2011)
其他刺激的反应
[edit | edit source]了解环境是决定细胞行为的主要因素,除了化学物质之外,还有其他感官刺激。大肠杆菌被发现会被蓝光(趋光性)所排斥,这是由大肠杆菌中的趋化受体对光的反应决定的,因为大多数细菌物种是以前的光合生物。利用光固定碳,它们产生了行为信号,现在允许大肠杆菌对光作出反应。(Adler 2011) (Berg 2011)
大肠杆菌已经表现出对热的一些反应。进行了更多测试以观察趋化系统对趋热性的影响。如果大肠杆菌缺少 3 种趋化蛋白(cheY|W|A),那么它们就不会对温度变化做出反应,而是趋化受体(Tsr、Tar、Trg、Tap)都表现出对细菌趋热性有一定的作用。分为两类,冷受体是 Tap,而 Tsr、Tar、Trg 在温度下降时表现出翻滚增加,反之,冷受体则会产生相反的反应。如果受体靠近其吸引物,则在甲基化后会表现出不同的行为。如果有丝氨酸,则由于 Tsr,不会有任何反应。可能提供的解释是,大肠杆菌“游泳”的原因是高温会导致变性,使其更具流动性。(Adler 2011) (Jeffory,Salman,Libchaber 2011)
渗透压在大肠杆菌被高渗透压和低渗透压排斥,而寻求最佳渗透压方面起着重要作用。这种趋渗性高度依赖于大肠杆菌的环境,变化会产生不同的影响。如果水从细胞中快速流动,它将是膨胀的,从而导致一个试图恢复原始条件的过程。细胞质水的量和浓度是生长控制因素,渗透压越低/越高,它移动的越少,反之,在最佳渗透压状态下移动的更多。(Adler 2011)
电生理学
[edit | edit source]如果对环境有不同的反应,那么电学特性也必须在 E. Coli 中发挥作用。尽管实验已经研究了 E. Coli 的动作电位,但还没有任何证据。事实证明,E. Coli 内存在电学变化,但没有接近动作电位的变化。E. Coli 的尺寸也证明是一个难题,因为它非常小。如果我们要测量电压,它会降解细胞壁并破坏细胞的功能。为了测量它们,到目前为止,科学家们监测了 E. Coli 菌株的闪烁行为并确定其功能。(Adler 2011) (McDonald 2011)
电生理学是所有心血管学科中发展最快的学科。电生理学家是心血管专家,他们接受了关于心律失常诊断和治疗的额外教育和培训。电生理学家与治疗心脏病患者的其他医生的密切合作非常重要。
电生理学研究 (EPS) 是一种可以帮助预测个人是否处于心源性猝死高风险的测试。以特定模式向心肌发送信号,以查看它们是否会刺激室性心动过速 (VT)。该测试在医院或诊所的安全且受控的电生理实验室中进行,患者没有危险。在 EP 研究中,局部麻醉剂用于麻醉腹股沟或颈部附近的区域,并将细小的导管送入心脏以记录其电信号。在研究过程中,医生会研究电信号通过心脏的速度和流动,识别节律问题并查明心脏肌肉中产生异常电信号的区域。无论如何,电生理学 (EP) 是一门新兴的医疗保健科学和疗法。EP 是心脏病学的一个亚专科,专注于心律失常的诊断和治疗。心脏电生理技术员可能来自各种盟友健康专业人员(RT、RN、CVT、EMT、RRT 和 PA),在诊断和侵入性程序中协助 EP 心血管专家,包括程序性电刺激、无菌擦洗技术、电解剖 3D 映射、心律失常的导管消融以及心脏节律管理的装置植入,如起搏器和其他先进的可植入装置。
电生理学研究可以:1) 识别哪些先前发生过心脏病或心肌梗塞的患者有发生严重室性心律失常的风险,可能还有 SCA。2) 帮助确定哪些患者可能需要积极治疗以预防心源性猝死。3) 识别心脏无法诱发危险心律失常的个体。他们似乎处于发生自发性、持续性 VT 的风险较低,这可能导致室颤和心源性猝死。
我们可能需要进行 EP 研究:1) 确定异常心律的原因。2) 确定异常心律起源的位置。3) 决定治疗异常心律的最佳方法。
参考文献
[edit | edit source]Adler, Julius (2011). "我与自然的生活". 生物化学年度评论. Retrieved 2011-10-27.
Berg, Howard (2004). "大肠杆菌的运动". 生物学和医学物理学生物医学工程. Retrieved 2011-10-29.
Jeffory,Salman,Libchaber, Marie,Hanna,Albert (2004/05). "大肠杆菌的趋热性" (PDF). 洛克菲勒大学. Retrieved 2011-10-29. {{cite web}}: Check date values in: |date= (help)CS1 maint: multiple names: authors list (link)
McDonald, Casey (2011). "大肠杆菌伏特计". 生物技术. 检索于 2011-10-29.
Foster, John W., Slonczewski, Joan L.. 微生物学. 第 1 版. 纽约. 2009.
