结构生物化学/DNA修复
由于DNA包含所有遗传信息和蛋白质生产的指令,因此确保DNA变化很少至关重要。DNA不断受到辐射和化学诱变剂的轰击,这些诱变剂会导致突变。然而,由于四种主要类型的DNA修复,突变率非常低。
人类基因组不断受到正常细胞条件(如自由基或DNA复制错误)以及外在条件(如紫外线辐射)的毒性压力。为了对抗这些压力并正确维护基因组,DDR途径,或DNA损伤反应途径已经进化。该途径的作用是检测错误或异常,传播检测信号,并激活系统来纠正问题。如果损伤无法修复,细胞将发生凋亡,或程序性细胞死亡,以避免将潜在的致命DNA错误传递下去。细胞不断遇到DNA损伤,因此DDR途径对细胞存活至关重要。
最致命的DNA损伤形式来自电离辐射,它会导致双链断裂。修复蛋白RAD51迅速在DNA损伤部位聚集。有人建议,损伤诱导的组蛋白变体H2AX磷酸化表明DNA断裂部位;许多其他修复蛋白也聚集在H2AX积累的这些部位。在缺乏H2AX的小鼠中,发现了免疫系统退化和肿瘤发生率增加。
细胞对DNA损伤反应的主要调节剂是ATM和ATR激酶(共济失调毛细血管扩张突变)通过调节超过700种蛋白质的磷酸化。这种磷酸化是DNA损伤信号传导的初始步骤。
“DNA损伤信号传导和修复中的结构动力学”是一篇由JJ Perry、Elizabeth Cotner-Gohara、Tom Ellenberger和John A. Tainer撰写的文章。在这篇文章中,DNA损伤反应是在揭示蛋白质在这些途径中的作用的方面进行研究的。DNA不断受到代谢物和毒物的损伤。因此,DNA修复和损伤反应对于生命的功能至关重要。DNA损伤涉及三个步骤。首先检测到损伤,然后将其移除,最后用正确的DNA序列替换。该途径再生一个3'末端,该末端将使用DNA聚合酶以未受损的链作为模板进行延伸。修复通过连接酶重新封闭DNA骨架来完成。由于修复过程会产生有毒的中间体,因此在修复DNA时需要强大的“遗传选择”。发现蛋白质结构与DNA损伤反应和修复途径内步骤的协调有关。这一点非常重要,因为蛋白质再次与DNA复制过程有关。
当不同的方法结合在一起时,可以详细研究DNA修复复合物的动力学。这些方法包括X射线晶体学、NMR、SAXS - 小角X射线散射、DXMS - 氢-氘交换质谱法等。这些方法提供了从纳米级到原子级的微小信息。例如,SAXS提供了关于溶液中大分子柔性的信息。它还提供了有关整个途径及其在溶液中的相互作用的信息。此外,DXMS显示了修复过程中发生的构象变化,详细程度相当于单个氨基酸的分辨率。因此,结合不同的结构生物化学方法有助于科学家发现DNA修复和损伤反应系统之间不同的协调。目前的研究发现,“不同酶构象之间的转变可能涉及非天然相互作用,从而降低了不同状态之间相互转换的能量势垒”(1)。这一发现非常重要,因为它描述了DNA修复复合物(构象变化)的变化与通过这些变化发生的生物学结果之间的联系。例如,如上所述,酶构象的变化会导致修复受损DNA过程中不同状态之间转换的活化能降低。另一个例子是,改变修复蛋白系统的正常蛋白质柔性和稳定性会导致严重的遗传疾病。发现DNA和ATP结合的变化与癌症有关,以及DNA修复框架的柔性和稳定性缺陷如何与衰老疾病(如Cockayne综合征或TTD)有关。
损伤修复是由多结构域核苷酸切除修复解旋酶(NER)执行的。这种酶从要修复的DNA的一条链中去除体积大且扭曲的切割。这是一个非常精确的过程,只有缺陷链被去除,而不影响未受损的DNA链,因为未受损的DNA链作为修改和修复过程的模板。NER蛋白以一种允许在实际去除DNA骨架之前验证损伤部位的方式组装。DNA修复过程的一个例子是酵母Rad4的执行,Rad4是一种多结构域蛋白,它与NER修复的螺旋的扭曲部分结合。该蛋白的结合被证明可以稳定扭曲的DNA结构。观察表明,Rad4通过DNA螺旋插入一个β发夹来重新定位其碱基。一个令人惊讶的发现是,Rad4不是与受损的DNA链结合,而是与未受损的DNA链结合。结果是,由于受损的DNA链,螺旋轴发生了偏移,导致结构弯曲,从而增加了Rad4与相邻发夹区域的DNA相互作用表面。这种延伸的相互作用创造了一个更稳定的受损DNA,尽管其碱基现在暴露在溶剂中。这种稳定性有助于NER修复受损链。
DNA损伤反应和修复中的另一个重要组成部分是BER - 碱基切除修复途径。BER和NER之间的区别在于BER能够检测和去除单个核苷酸,这些核苷酸具有最小的修饰,例如添加一个单一的甲基。因此,它在修复扭曲的DNA链方面非常有效。在BER中,发现氧化损伤特异性糖基化酶OGG1和MutM与8-oxoG碱基相互作用。8-oxoG碱基由氢键供体N9和受体O8组成。它们与OGG1相互作用,并提供对受损DNA的选择性切割。整个复合物被称为假米氏复合物。总体而言,从NMR、X射线晶体学到SAXS等方法的组合观察到了DNA损伤反应和修复过程中的不同机制。
下面是DNA修复过程的图像,其中DNA连接酶I正在修复染色体损伤。

DNA修复包括检测现有损伤和实际修复这种损伤。9-1-1是一种异三聚体蛋白,由三个亚基组成,其中至少一个亚基与其他两个亚基不同,它围绕DNA包裹,以启动特定检查点蛋白的募集并暂时冻结细胞周期。更具体地说,它会导致Sc-Mec1/Hs-共济失调毛细血管扩张突变的磷酸化,其中Sc-和Hs-前缀分别指酿酒酵母(一种真核生物)和智人,以及Rad3。Chk1和Sc-Rad53/Hs-CHK2蛋白激酶被激活,导致细胞周期G1/S、S内或G2/M阶段的抑制。修复基因的积累、复制叉的固定以及细胞周期蛋白(促进细胞周期的蛋白质)产生的减少也是这种激活的结果。9-1-1与Sc-Cdc28协同作用,选择性地积累Sc-Ddc2。Sc-Ddc2/Hs-ATRIP、Sc-Mec1/HS-ATR和9-1-1的共同存在激活了检查点,无论是否检测到DNA损伤。
错配修复纠正了复制过程中DNA聚合酶校对能力无法纠正的核苷酸配对错误。错误配对的碱基核苷酸会导致DNA二级结构的变形。MSH2和MSH6二聚体结合到链上的错配处。然后,内切核酸酶MLH1将与MSH结合,并切断该链。然后,外切核酸酶将降解两者之间的区域,然后允许DNA聚合酶δ放置正确的核苷酸,而DNA连接酶将重新连接该链。利用这种能力,该酶切除了新DNA链的扭曲部分,然后使用旧DNA链作为模板填补空白。在大肠杆菌中,错配修复酶通过某些序列上甲基的存在来识别旧DNA链。在真核细胞中,尚不清楚该酶如何区分旧DNA链和新DNA链。

在直接修复中,不是替换整个核苷酸,而是将错误的核苷酸结构改变为正确的核苷酸。来自太阳的紫外线通过在相邻嘧啶之间形成共价键而导致嘧啶二聚体。一些真核细胞有一种叫做光解酶的酶。这种酶利用光能来打破嘧啶二聚体之间的共价键。
DNA 修复是由核苷酸切除修复 (NER) 解旋酶执行的,这是一种由多个结构域组成的蛋白质。NER 以逐步的方式组装在受损 DNA 区域周围(由于其错误,包含凸起或病变,鼓励 NER 结合),从而可以在执行实际切除之前仔细验证损伤。例如,酵母 Rad4 蛋白(哺乳动物 XPC 的类似物)通过结合附近的未损伤区域间接检测 DNA 损伤。受损的 DNA 链是灵活的,允许形成一个稳定的复合物,其中包括 Rad23,该蛋白实际上修复了损伤。
如果 XPC-Rad4 无法检测到受损位点,则一种替代方案涉及 DDC1-DDC2 二聚体。该二聚体与受损 DNA 区域和泛素连接酶形成复合物。该复合物泛素化 XPC 和 DDC2,后者随后释放 DNA 分子,将其传递给 XPC 和正常的 NER 过程。
核苷酸切除修复可以分为两类:全局基因组修复和转录偶联修复。
全局基因组修复涉及 XPC 和 hHR23B 二聚体结合受损 DNA,然后转录因子 2H (TFIIH) 结合该复合物。然后 XPG 结合,DNA 被进一步解旋。核酸酶 XPG 和 XPF 切割 DNA,这基本上去除了受损的 DNA。然后 DNA 聚合酶 delta 用正确的核苷酸填补间隙,然后 DNA 连接酶重新连接该链。
转录偶联修复是当 RNA 聚合酶在受损位点停滞时,然后 Cockayne 综合征 B 蛋白 (CSB) 取代 RNA 聚合酶并招募 TFIIH 和 XPG。在核酸酶 XPG 和 XPF 切割 DNA 之前,DNA 被解旋。然后去除受损部分,DNA 聚合酶 delta 填补间隙,连接酶重新连接该链。
来源:分子细胞生物学,Lodish 等人,第 6 版(2008 年),第 145-160 页
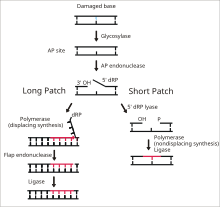
并非所有损伤都大到足以导致 NER 检测到的病变。碱基切除修复 (BER) 途径修复单核苷酸错误,有时仅限于添加一个甲基。虽然这些损伤很小,但它们通常足以阻碍 DNA 复制或产生非功能性蛋白质。BER 途径中的损伤检测很困难,因为除了错误很小之外,还有很多错误。许多酶用于检测不同的微小错误并启动 BER 途径。
碱基切除修复的第一步是切除修饰的核苷酸。称为 DNA 糖基化酶的酶,每种酶都有其自身的识别特定类型修饰碱基的能力,它们切断脱氧核糖糖的 1'-碳和碱基之间的键并去除碱基。然后称为脱嘌呤或脱嘧啶 (AP) 核酸内切酶的酶断裂磷酸二酯键,另一种酶去除脱氧核糖糖。DNA 聚合酶来临并向游离的 3'OH 基团添加正确的核苷酸。最后,DNA 连接酶通过形成磷酸二酯键连接 DNA 链。
DNA 的糖-磷酸主链的损伤由 DNA 连接酶修复。由于 DNA 主链对所有生物体都是通用的,因此这些连接酶也存在于所有使用 DNA 作为其遗传物质的生物体中。DNA 连接酶通过三个步骤过程密封主链中的断裂。在第一步中,酶的几个结构域采用特定构象,使活性位点赖氨酸残基腺苷酸化。在最后两个步骤中,酶环绕断裂的 DNA 链并融合两个末端。
DNA 双链中的断裂很常见,但对细胞特别有害,因为遗传突变的可能性增加。双链断裂的主要原因包括来自氧化代谢的活性氧、电离辐射和酶错误。该链可以以两种主要方式之一修复:同源重组修复和非同源 DNA 末端连接途径 (NHEJ)。
任何二倍体生物体都可以使用同源重组修复,即使二倍体是暂时的,就像在细菌中一样。同源重组修复的类型包括同源重组、单链退火和断裂诱导复制。在同源重组中,在细胞周期中的 S 期,需要一个相同或几乎相同的 DNA 序列作为修复的模板,该阶段仅发生在 DNA 复制期间和之后不久,以及有丝分裂之前。然后核苷酸序列在相似的链之间交换。
NHEJ 作为同源重组修复的替代方案出现,因为模板供体通常在非分裂细胞中不可用。NHEJ 具有非凡的灵活机制,具有广泛的底物多样性,可以转化为所需的产物。与其他 DNA 修复过程一样,它需要三种主要蛋白质:一种核酸酶来切除受损的 DNA、一种聚合酶来填充新的 DNA 以及一种连接酶来修复该链。关键成分包括 Ku、DNA-PKcs、Artemis、Pol x 聚合酶以及由 XLF、XRCC4 和 DNA 连接酶 IV 组成的连接酶复合物。然后每个 DNA 末端可以被独立地修改多次,并且由于其灵活的性质,允许用其他酶进行替换。双链断裂处连接异质 DNA 末端的问题被证明在原核生物和真核生物中是趋同进化的。
- Huen, M. SY. "DNA 损伤位点的检查点和修复机制的组装。" 生物化学科学趋势,第 35 卷,第 2 期,101-108,2009 年 10 月 28 日
- Perry JJ, Cotner-Gohara E, Ellenberger T, Tainer JA。“DNA 损伤信号和修复中的结构动力学”。Curr. Opin. Struct. Biol. 2010 年 6 月;20(3)
- Pierce,Benjamin A.,Jung H. Choi 和 Mark E. McCallum。遗传学:概念方法。纽约,纽约:W.H. Freeman,2008 年。印刷版。
- Lieber MR。非同源 DNA 末端连接途径修复双链 DNA 断裂的机制。Annu Rev Biochem。2010;79:181–211。
- Perry, J. Jefferson P.,Elizabeth Cotner-Gohara,Tom Ellenberger 和 John A Tainer。“DNA 损伤信号和修复中的结构动力学”。结构生物学现状。 (2010):283-294。ScienceDirect。
- Eichinger, S. Christian 和 Stefan Jentsch。“9-1-1:PCNA 的专业表亲”。生物化学科学趋势,第 36 卷,第 11 期,563-568,2011 年 10 月 4 日。

