结构生物化学/焓
在特定温度和压强下的反应焓定义为反应物在恒温恒压条件下转化为产物时系统与周围环境之间交换的热量。流入系统的热量用正号表示。此外,标准生成焓是指在 1 巴压强下指定反应的一摩尔生成焓。“焓”这个词及其准确定义直到 1840 年代后期才出现。在此之前,科学家和工程师通过经验得知,当两个物体接触时,一种称为热的流体从较热物体转移到较冷物体。结果是,冷物体变热,热物体变冷,因为热量在它们之间转移。焓也是反应物在恒压下转化为产物时吸收或释放的热能。当焓为负时,热能被释放。然而,当焓为正时,反应物从周围环境中吸收热量。
一个合理的观点是,有一些东西从热物体转移到冷物体。这个“东西”被称为热量。因此,说热量总是从较高温度流向较低温度很方便。这个结论确立了温度梯度的概念,可以看作是能量作为热量传递的驱动力。后来,通过进行更精确的测量和实验,科学家得出结论,热量从一个物体传递到另一个物体的速率与两个物体之间的温差成正比。因此,当两个物体之间的温差可忽略不计时,热量传递可忽略不计。
从热力学的角度来看,热量(或在热物体和冷物体之间传递的能量)永远不会被认为是存储在物体中的。从这个角度来看,热量仅在能量从一个物体转移到另一个物体时才存在;或者用热力学术语来说,从系统到周围环境。当热量添加到系统或其周围环境中或从系统或其周围环境中减去时,人们认为能量没有被存储在接触点或被拉离接触点。相反,人们认为热量充当动能和势能。加减过程被认为是从势能到动能的转移,反之亦然。
尽管热量具有瞬态特性,但热量的定义始终被视为正在测量的物体的独特属性。如上所述,温度变化被用作测量热量的主要单位,直到 1840 年代后期。事实上,热量单位的定义是基于单位质量水的温度变化,如英国热量单位所示。英国热量单位通常被称为 Btu。
英国热量单位定义为将 1/180 的热量传递到一公斤质量的水中,使其在标准大气压下从 0 摄氏度升高到 100 摄氏度。这种热量的原始定义未能提供准确的测量。造成这种不准确的主要原因在于参考物体,在本例中为水。测量的温度变化部分取决于水的纯度。水越纯,温度升高一度所需的热量就越多。
在 20 世纪,越来越多的科学家意识到,热量只是另一种形式的能量,通过两个物体的接触而转移。因此,用能量单位测量热量既方便又实用。
焓或热量的现代概念主要是基于詹姆斯·普雷斯科特·焦耳 (1818-1889) 进行的一系列实验。焦耳的实验涉及在绝缘容器中仔细测量的水、油和汞的量。他在容器中放入已知量的上述物质,并用旋转搅拌器搅拌这些流体。进行旋转所需的机械功被仔细计算,并且流体温度的变化被精确测量。焦耳在他的结果中指出,对于每种流体,每单位质量每升高一度温度所需的机械功是固定的。此外,可以通过与较冷物体接触来简单地传递热量来恢复流体的原始温度。因此,焦耳的实验牢固地确立了热量与功之间的定量关系,它明确证明了热量是一种能量形式。
为了给热量一个更具体的定义,更重要的是,为了认识到所有能量单位的共同基础,国际蒸汽表卡路里被定义为与焦耳(能量的 SI 单位)相关。焦耳是在一牛顿力的作用下沿一米距离做的机械功。在建立 SI 单位后,国际蒸汽表卡路里被定义为等效于 4.1868 焦耳(精确定义),热化学卡路里被定义为等效于 4.184 焦耳(精确定义)。作为参考,一个国际蒸汽表 Btu 等效于 1055.056 焦耳,一个热化学 Btu 等效于 1054.35 焦耳。
焓 (H) 是衡量反应热能的一种方法。一个热力学系统的焓 H,其内能、压强和体积分别为 U、P 和 V,定义为 H =U+PV。由于 U、P 和 V 是状态函数,因此 H 是状态函数。从 dw=-PdV 注意到 P 和 V 的乘积具有功的量纲,因此具有能量的量纲。因此,将 U 和 PV 加在一起是合理的。自然地,H 具有能量单位。
例如,一个放热反应的焓变为负。这是因为产物的焓小于反应物的焓。
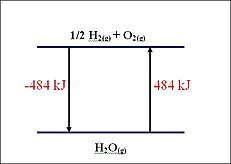
用数学术语来说,反应的焓可以表示为以下形式
ΔH =(断裂键的总和)-(形成键的总和)
ΔH = ΣnH产物 - ΣnH反应物
当 ΔH 为负时,反应为放热,形成的键比断裂的键更多。
如果 ΔH 为正,则反应为吸热。化学键倾向于自发形成,ΔH 的负值代表放热反应。
逆反应的焓在大小上相等,但在数学符号上相反。
焓是一个状态函数,因此根据盖斯定律,反应的总焓等于可以将总反应分解的各个反应或步骤的焓之和。
由于焓是为计算目的而定义的函数,因此很难测量物质的实际焓。然而,焓变很容易测量,并且是许多计算中的一个重要量。
当焓发生变化时,表示系统中发生了状态变化。但焓是可逆的,因为物理状态变化通常是可逆的。因此,由于所有物质的生成焓总是给定的,那么在任何给定的变化中,都可以计算出新的焓。
Slonczewski, Joan L. . 微生物学“一项不断发展的科学”。第二版。
Smith, J.M. (2005). 化学工程热力学导论. McGraw Hill. ISBN 978-007-127055-7. {{cite book}}: Text "coauthors+ H.C. Van Ness, M.M. Abbott" ignored (help)
Engel, Thomas. 物理化学。第三版。
