结构生物化学/酶/pH对酶活性的影响
pH的变化会影响酶。最有利的pH值被称为最佳pH值。这是酶最活跃的点。这在图中以图形方式说明。
极高或极低的pH值通常会导致大多数酶完全失去活性。pH也是酶稳定性的一个因素。与活性一样,每种酶也有pH最佳稳定性的区域。pH的变化会影响酶。这在图中以图形方式说明。File:Optimum pH.png
极高或极低的pH值通常会导致大多数酶完全失去活性。pH也是酶结构稳定性的一个因素。与活性一样,每种酶也有pH最佳稳定性的区域。
pH的变化会影响酶。这在图中以图形方式说明。File:Optimum pH.png
除了温度和pH外,还有其他因素,例如离子强度,也会影响酶促反应。为了使酶促反应准确且可重复,必须考虑和优化这些物理和化学参数。
酶通常在5-9的pH范围内最活跃。这是因为蛋白质在反映此pH的环境中发挥作用。蛋白质具有狭窄的pH范围的原因有很多。各种氨基酸残基以及蛋白质的羧基和酰胺末端在细胞内pH范围内具有pKa范围。因此,pH的变化会使侧基质子化或去质子化,从而改变其化学特征。例如,在去质子化下,羧基末端可能失去与相邻亚基的相互作用,从而改变酶构象。总之,这种构象会导致底物亲和力降低。更剧烈的pH变化会改变蛋白质折叠,从而完全失活酶或导致不可逆的蛋白水解。
然而,pH变化可以被酶用于调节或蛋白质功能。例如,当血浆呈酸性时,血红蛋白会形成盐桥。因此,血红蛋白的T状态稳定,对氧气的结合亲和力降低。这有利于将更多的氧气输送到缺氧的肌肉。
1. 底物与酶的结合。
2. 酶催化位点的氨基酸残基的电离状态。
3. 底物的电离状态。
4. 蛋白质结构的变化(在极端的pH值下更明显)。
当许多酶促反应速率是pH的函数时,它们会遵循钟形曲线。
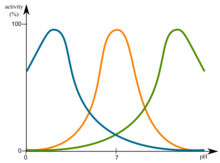
这些曲线反映了氨基酸残基的电离状态,这些残基必须具有特定的电离状态才能进行酶促活性。观察到的pK值(最大值点)通常暗示了对酶活性至关重要的氨基酸残基的特性。例如,观察到的pK值为~4表明Asp或Glu对酶至关重要。pK值为~6可能暗示了His残基,而pK值为~10则暗示了Lys残基。
然而,重要的是要记住,酶所处的微环境也会影响其活性。例如,在非极性环境中或靠近另一个Asp残基的Asp残基比在任何其他环境中更强烈地吸引质子,并且具有更高的pK值。
此外,pH对酶的影响会导致酶变性,而不是特定催化残基的质子化或去质子化。
可以通过进行定点诱变来替换特定残基。这样做为研究人员提供了一种可靠的方法来识别对底物结合或催化所必需的残基。
波尔效应以克里斯蒂安·波尔命名,他研究并发现了氢离子和二氧化碳的影响。血红蛋白协同性的发现帮助波尔研究了pH对酶的影响。在这个特定案例中,重点是氢离子对血红蛋白蛋白和酶的影响。在了解波尔效应之前,需要解释血红蛋白的协同性。在血红蛋白的协同性中,当氧气浓度高时,氧气的释放得到促进。这是因为特殊的血红蛋白特性促进了氧气结合,当一个活性位点首先与氧气结合时。血红蛋白的这种能力将使它们能够响应其他生理信号,在这些信号中需要更多的氧气。
在这种情况下,收缩肌肉中代谢旺盛的组织通常会产生高浓度的氢离子和二氧化碳,它们是别构效应器,与血红蛋白上非氧结合位点结合。波尔效应是指氢离子和二氧化碳调节血红蛋白上的氧结合位点。
众所周知,氢离子会降低溶液中的pH值,这种现象通常会降低血红蛋白对氧气的亲和力,换句话说,它会增加氧气的释放。因此,在高pH值下,组氨酸(Beta-146)的侧链没有被质子化,盐桥没有形成,而在低pH值下,组氨酸的侧链在被质子化时会形成盐桥。这将导致血红蛋白中T状态的稳定,这也增加了氧气的释放。
当二氧化碳通过人体时,发生的第一个机制是它与水反应生成碳酸(H2CO3),由碳酸酐酶加速。碳酸很容易解离成HCO3- 和 H+,并降低pH值,如前述机制所述。
二氧化碳影响血红蛋白中氧亲和力的另一种方式是二氧化碳和血红蛋白的直接机制。二氧化碳通过与末端氨基反应形成氨基甲酸盐基团(负电荷)来稳定脱氧血红蛋白(T状态)。然后,这些氨基甲酸盐基团可以自由形成盐桥,从而稳定T状态并释放氧气。氨基甲酸盐基团的形成由碳酸酐酶催化。氨基甲酸盐基团形成后,氨基甲酸盐会解离成碳酸氢根离子和质子。盐桥通过质子化组氨酸形成,然后与天冬酰胺形成桥。
由于所有酶都有一个最佳pH值,在该pH值下其催化活性达到峰值,因此酶也有一个最佳温度。有两种已知的酶热性质会影响催化速率。这两个是活化能和热稳定性。然而,温度与酶活性之间的实验数据并没有清楚地与人们所寻求的活性仅仅随着温度升高而增加的观点相符。一种称为平衡模型的新模型通过引入酶的非活性形式,为反应条件下酶热行为提供定量解释,形成一个遵循基本化学中勒沙特列原理的类似规则的平衡系统。平衡模型在消除人们认为在酶活性与温度之间的经典观点中重要的时间依赖性方面提供了一些见解。平衡模型背后的理念是,在不同的温度梯度下,与活性形式一起添加的酶的非活性形式通过平衡力学阻止活性酶的完全失活。但是应该注意的是,必须了解酶的非活性形式和活性形式之间的差异。平衡模型通过纯粹地根据其活性位点集中其活性来描述酶的非活性形式。酶的活性位点是底物能够结合的位点,然后继续进行酶的构象变化,然后进一步进行预期的生化反应。该模型中的非活性酶被描述为与酶的活性形式相比仅仅是折叠变化。这不能与变性的酶混淆。变性的酶是完全改变的酶,包括活性位点,其程度已达到酶完全无法发挥作用的地步,换句话说,它是不可逆的酶构象变化。在平衡模型的情况下,该模型的机制之所以有效,仅仅是因为酶的非活性形式的可逆性。酶的非活性形式可以逆转回其活性形式,这与提出的模型的平衡力学背后的整个理念完全一致。
Berg, Jeremy "生物化学", 第7章 血红蛋白:蛋白质作用的肖像. 193-194. 第六版. Freeman and Company, 2007. http://hrsbstaff.ednet.ns.ca/sdosman/Higher%20level%20BIO/enzymenotes3.6.htm
Roy M. Daniel, Michael J. Danson, 温度如何影响酶催化活性的新认识, 生物化学趋势, 第35卷, 第10期, 2010年10月, 第584-591页, ISSN 0968-0004, 10.1016/j.tibs.2010.05.001.
