结构生物化学/血红蛋白

血红蛋白(在许多英语变体中拼写为 Haemoglobin,通常缩写为“Hb”)是一种四聚体,由两个二聚体组成,它们与氧气结合。血红蛋白是红细胞中运输氧气的蛋白质,是一种具有四级结构的球状蛋白。血红蛋白由四个多肽亚基组成;两个 α 链和两个 β 链。血红蛋白将氧气从肺部运输到身体的其他部位。血红蛋白的三维结构是由马克斯·佩鲁茨在 1959 年使用 X 射线晶体学解决的。血红蛋白的结构与肌红蛋白中的单多肽链非常相似,尽管它们在 83% 的残基处氨基酸序列不同。这突出了蛋白质结构中一个相对常见的主题:非常不同的初级序列可以指定非常相似的三维结构。
血红蛋白存在两种状态,即 T 状态(紧张状态)和 R 状态(松弛状态)。T 状态对氧气的亲和力低于 R 状态。在协同性的协调模式中,血红蛋白必须处于 T 状态或 R 状态。在协同性的顺序模式中,单体的构象状态在它与氧气结合时发生变化。对血红蛋白的实际实验观察表明,它比这两种模型都更复杂,介于两者之间。血红蛋白的构象也会随着氧气与铁的结合而发生变化,从而提高了结合铁和组氨酸残基的水平。氧气结合使铁离子的位置改变了大约 0.4 Å。在氧合之前,铁离子略微位于卟啉平面之外,在氧合后,它移动到血红素平面上。血红蛋白对氧气的亲和力随着 pH 值的降低而降低。这很有用,因为血红蛋白在肺部对氧气的亲和力很高,可以有效地与更多的氧气结合。一旦它到达肌肉,那里的 pH 值较低,降低的氧气亲和力使血红蛋白可以将氧气释放到组织中。当二氧化碳扩散到红细胞中时,它的解离也会导致 pH 值下降。
血红蛋白对氧气的亲和力低于其结构类似物肌红蛋白。有趣的是,然而,这并不影响血红蛋白对身体的有用性;相反,它使血红蛋白成为比肌红蛋白更有效的氧气载体。这是因为血红蛋白比肌红蛋白更容易释放氧气。虽然将氧气输送到身体的不同部位很重要,但更重要的是氧气在需要时被释放。给定蛋白质对氧气的亲和力越高,该蛋白质在需要时释放氧气的难度就越大。因此,血红蛋白对氧气的亲和力较低,对它有利,因为它使血红蛋白更容易在体内释放氧气。另一方面,肌红蛋白对氧气的亲和力明显更高,因此一旦结合,它将不太愿意释放它。因此,血红蛋白对氧气的亲和力低于肌红蛋白,使其在结合和随后释放氧气物种方面具有更高的整体效率。出于这个原因,身体往往更频繁地使用血红蛋白来分配氧气,尽管肌红蛋白也被使用,特别是用于将氧气输送到肌肉细胞。可以在相应的章节中了解更多关于肌红蛋白的信息。
同样值得一提的是,胎儿血红蛋白对氧气的亲和力明显高于母体血红蛋白。这对人类女性(以及其他怀孕的哺乳动物女性)的妊娠期间至关重要,因为它使胎儿能够在发育过程中获得所需的氧气。基本上,存在于胎儿体内的血红蛋白能够在母体血液接触胎儿物质时从母体血红蛋白中剥夺氧气物种。母体血液中没有接触胎儿的那一部分会像正常一样将氧气转移到母体的器官系统。
当氧气与血红蛋白结合时,颜色会变成深红色。当氧气未结合时,颜色会变成深“朴素”的红色[2]。血红蛋白对氧气的亲和力随着与氧气结合的氧气越多而增加。解离曲线表示血红蛋白如何通过其 S 形曲线对氧气具有协同性。 - 左移表示氧气亲和力的增加。血红蛋白有更好的机会抓住氧气。这通常发生在环境因素发生变化时,例如低温、低代谢率和高 pH 值。
- 右移表示亲和力的降低。血红蛋白更容易释放氧气。这是由于高温、高代谢率和低 pH 值引起的。
虽然血红蛋白有 4 个亚基,但肌红蛋白只有一个亚基。它是细胞内氧气储存的酶(存在于骨骼肌细胞中)。肌肉呈红色是因为它们含有大量的肌红蛋白。潜水哺乳动物等生物体内含有大量的肌红蛋白,因此它们可以在长时间内不呼吸。
如上所述,血红蛋白存在两种不同的状态:T 状态和R 状态。血红蛋白的 T 状态是两者中更“Tense”的;这是血红蛋白的脱氧形式(意味着它缺乏氧气物种),也称为“脱氧血红蛋白”。血红蛋白的 R 状态更“Relaxed”,是完全氧合的形式;它也称为
“氧合血红蛋白”。
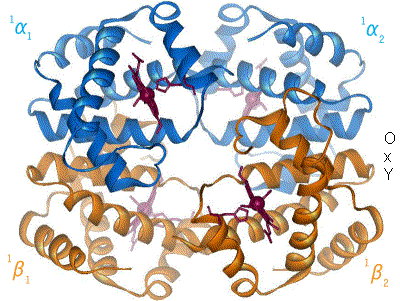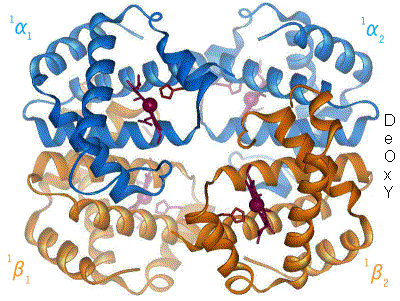
血红蛋白的独特特征之一是它表现出协同性。这意味着血红蛋白可以向其各种功能基团传递分子内信息,以帮助它获得对目标配体的最大亲和力,在本例中是氧气。当血红蛋白的一个单体与氧气结合时,它会提醒附近其他血红蛋白单体开始结合过程。这意味着,随着越来越多的氧气被血红蛋白单体结合,血红蛋白的亲和力也会越来越高。换句话说,血红蛋白的亲和力与其在给定时间结合的氧气数量成正比。这使血红蛋白能够随着时间的推移增加其对氧气的亲和力,这种特性将其标记为体内最灵活的蛋白质之一。因为它可以改变其对氧气的亲和力,所以血红蛋白可以表现出一系列不同的亲和力。如前所述,这使其在氧气结合量方面非常灵活,因此它可以释放多少氧气。这是身体更喜欢使用血红蛋白而不是肌红蛋白进行氧气运输的原因之一:血红蛋白可以改变其自身对氧气的亲和力以适应当前情况,使其能够处理更广泛的化学环境和器官系统,同时仍然能够有效地分配氧气。


血红蛋白的协同作用主要有两种模型。其中一个是协同模型。该模型指出,血红蛋白分子在 R 状态和 T 状态之间快速转换,以最大程度地提高其对氧气的亲和力。根据该模型,血红蛋白不断地在两种状态之间“翻转”,试图尽可能多地结合氧气。另一个模型是顺序模型。该模型认为,血红蛋白的一条链会启动一系列构象变化,从而提高其对氧气的亲和力。当血红蛋白的一条链结合氧气时,血红蛋白会以有利于额外氧气结合的方式重新排列。当下一个氧气结合时,会发生另一种构象变化,以进一步补充结合;因此,血红蛋白可以随着其越来越多的链结合氧气而顺序地提高其对氧气的亲和力。
从血红蛋白动力学实验获得的实验数据表明,协同模型和顺序模型都没有得到强烈支持。如果有的话,数据表明血红蛋白的行为代表了两种模型的混合;因此血红蛋白的协同作用介于协同模型和顺序模型之间。
众所周知,血红蛋白在与氧气结合时会发生多种构象变化。首先,一旦血红蛋白中的铁阳离子开始移动,血红蛋白的组氨酸残基和α-螺旋也会开始移动,以稳定铁离子移动引起的改变。其次,α-螺旋的羧基末端通常位于构成血红蛋白的两个α-和β-二聚体之间的界面。最后,羧基末端的位移变化为血红蛋白的 T 状态和 R 状态之间的转换创造了有利条件。
以上描述清楚地表明,协同模型和顺序模型不能完全解释血红蛋白的行为,也不能解释相关蛋白类的行为。为了解释这种差异,人们设计了更复杂的模型,更准确地反映了从血红蛋白结合实验中获得的动力学数据。
氧气结合曲线
[edit | edit source]氧气与血红素中铁的结合会从亚铁离子中拉出部分电子密度到氧气分子。重要的是,当氧气释放时,要将肌红蛋白留在双氧形式而不是超氧化物形式,因为超氧化物可以自行生成新的形式,对许多生物材料产生负面影响,而且超氧化物还会阻止铁离子以其三价铁状态 (Metmyoglobin) 结合氧气。与稳定的 O2 分子相比,超氧化物和超氧化物衍生的氧物种反应性很强,它们可能会对细胞内部及其环境产生破坏性影响。肌红蛋白中一个远端的组氨酸残基调节血红素基团的反应性,使其更适合结合氧气。它是通过与氧气分子形成氢键来实现的;氧气分子的额外电子密度使氢键异常牢固,因此作为稳定剂更加有效。
氧气结合曲线是显示部分饱和度与氧气浓度关系的曲线图。根据定义,部分饱和度表示存在结合了氧气的结合位点。部分饱和度范围可以从零(所有位点为空)到一(所有位点都被填充)。氧气浓度由分压决定。
与肌红蛋白对氧气的亲和力相比,血红蛋白对氧气的亲和力相对较弱。血红蛋白的氧气结合曲线呈S形曲线。这是由于血红蛋白的协同作用。当血红蛋白从肺部运输到组织时,其周围环境的 pH 值会降低,与之反应的 CO2 量也会增加。这两种变化都会导致血红蛋白失去对氧气的亲和力,从而使其将氧气释放到组织中。这导致血红蛋白在氧气结合曲线中呈现 S 形曲线,证明了其协同作用。
 File:Oxygen binding curve with hemoglobin and myoglobin.jpg
File:Oxygen binding curve with hemoglobin and myoglobin.jpg
这张图显示了血红蛋白与肌红蛋白的氧气结合亲和力对比,以及如果血红蛋白不表现出协同作用则必须遵循的假设曲线。从这张图中,你可以看到血红蛋白的 S 形曲线,它一开始与肌红蛋白的亲和力略低,但在肺部与氧气的亲和力相当。随着压力的下降以及肌红蛋白和血红蛋白向组织移动,肌红蛋白仍然保持着对氧气的很高亲和力,而血红蛋白由于其协同作用,突然失去了其亲和力,因此使其比肌红蛋白更有效地运输氧气。灰色曲线表示没有协同作用,表明为了在组织中获得所需的低氧气亲和力,血红蛋白的初始氧气亲和力将会更低,因此在从肺部输送氧气方面效率较低。
血红蛋白的氧气结合曲线
[edit | edit source]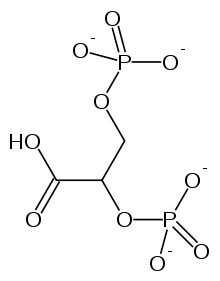
在红细胞中,血红蛋白的氧气结合曲线呈现“S”形,称为 S 形曲线。S 形曲线表明氧气结合是协同的;也就是说,当一个位点结合氧气时,其余未被占据的位点结合氧气的概率会增加。
协同行为的重要性在于它使血红蛋白能够更有效地运输氧气。例如,在肺部,血红蛋白的饱和度为 98%。但是,当血红蛋白存在于组织中并释放氧气时,饱和度下降到 32%;因此,66% 的潜在氧气结合位点参与了氧气的运输。
纯化的血红蛋白与氧气结合得更紧密,使其在氧气运输中作用不大。这种特性差异是由于人体血液中存在 2,3-二磷酸甘油酸 (2,3-BPG),它充当变构效应物。变构效应物在一个位点结合并影响另一个位点的结合。2,3-BPG 结合到血红蛋白 T 状态的口袋中,并在其形成 R 状态时释放。2,3-BPG 的存在意味着必须有更多的氧气与血红蛋白结合,才能发生向 R 形式的转变。
其他调节,如血红蛋白的波尔效应,也可以通过氧气结合曲线来描述。通过分析氧气结合曲线,可以观察到氧气亲和力与 pH 值之间存在比例关系。随着 pH 值降低,血红蛋白对氧气的亲和力也会降低。因此,当血红蛋白接近低 pH 值区域时,会释放更多的氧气。这种波尔效应的化学基础是由于形成四级结构的两个盐桥。一个盐桥是由 β-组氨酸 146(羧基末端基团)与 α-赖氨酸 40 之间的相互作用形成的。这种连接将有助于将组氨酸残基定向,以便在另一个盐桥的形成中与带负电荷的天冬氨酸 94 相互作用。第二个桥是在组氨酸残基上额外加一个质子的帮助下形成的。
当二氧化碳扩散到红细胞中时,它会在内部与水反应形成碳酸。碳酸解离导致 pH 值降低,并稳定 T 状态。
氧气结合曲线还可以显示二氧化碳存在对血红蛋白的影响。二氧化碳的调节作用类似于波尔效应。比较二氧化碳在血红蛋白中缺失和存在的影响发现,当二氧化碳存在时,血红蛋白更有效地将氧气从组织运输到肺部。这种效率的原因是二氧化碳也会降低血红蛋白对氧气的亲和力。二氧化碳的加入会导致 pH 值下降,进而导致血红蛋白对氧气的亲和力降低。这在组织中非常明显,因为组织中储存的二氧化碳被释放到血流中,然后发生反应,将 H+ 释放到血流中,增加酸度并降低 pH 值。
File:Reason carbon dioxide decreases pH.jpg
血红蛋白的变构效应物
[edit | edit source]变构调节是通过其他分子控制蛋白质行为的过程;执行这种调节的分子被称为变构调节剂。该过程涉及变构调节剂分子与目标蛋白质的结合;结果是对蛋白质功能产生明显的影響。增加或补充给定蛋白质功能的变构调节剂被称为变构激活剂。降低或中断给定蛋白质功能的变构调节剂被称为变构抑制剂。
血红蛋白与其他蛋白质一样,也拥有变构调节剂。对于血红蛋白这样重要的蛋白质来说,调节是必不可少的,因为它对氧气的亲和力必须适合其当前处理的特定器官系统。因此,血红蛋白大多数变构调节剂的主要任务是微调其氧气亲和力,以匹配当前的情况。
细胞使用变构抑制剂的优势: - 在典型的代谢途径中,途径的最终产物充当变构抑制剂。 - 它会抑制途径中的第一个酶,从而节省细胞在最终产物过剩的代谢途径中消耗资源。
二磷酸甘油酸或 BPG 是血红蛋白的众多变构调节剂之一。该分子结合到血红蛋白脱氧形式 (T 状态) 的中央腔并稳定它。T 状态的稳定性增加导致对氧气的亲和力降低,因为通常是 T 状态的强烈应变推动脱氧血红蛋白结合氧气;一旦结合了氧气,T 状态就会失去应变并松弛到 R 状态。因此,通过稳定通常紧张的 T 状态,BPG 使血红蛋白不太可能为了释放应变而结合氧气。这种机制是必要的,因为血红蛋白的 T 状态非常不稳定,平衡非常强烈地有利于 R 状态,几乎没有氧气被释放。换句话说,纯血红蛋白与氧气结合非常紧密。因此,需要 2,3-BPG 来稳定 T 状态。由于 BPG 降低了血红蛋白对氧气的亲和力,因此它是血红蛋白的变构抑制剂。如果没有 2, 3-BPG,血红蛋白将是将氧气从肺部运输到组织的极其低效的运输者,仅释放其氧气含量的约 8%。然而,在存在 2,3-BPG 的情况下,血红蛋白四聚体中必须填充更多的氧气结合位点,才能从 T 状态转变为 R 状态。为了使血红蛋白从低亲和力 T 状态转变为高亲和力 R 状态,必须达到更高的氧气浓度。
2,3-BPG 的结合还有其他生理后果。胎儿血红蛋白比母体血红蛋白具有更高的氧气结合亲和力。胎儿红细胞比母体红细胞对氧气具有更高的亲和力,因为胎儿血红蛋白不像母体血红蛋白那样能很好地结合 2,3-BPG。这种氧气亲和力差异的结果是氧气能够有效地从母体红细胞转移到胎儿红细胞。
**pH值** 或溶液中的质子浓度是血红蛋白的另一个变构调节剂。有趣的是,pH值既可以作为变构激活剂,也可以作为抑制剂,这取决于pH值变化的方向。例如,当pH值下降时,血红蛋白对氧气的亲和力也会下降。这是因为质子有助于在血红蛋白的T状态下构建盐桥。一般来说,血红蛋白的T状态受三个形成两个盐桥的氨基酸的青睐;其中一个盐桥需要一个额外的质子才能成功形成。因此,溶液中质子浓度越高(或pH值越低),该盐桥就越容易形成。更好的盐桥形成会导致更好的、更稳定的T状态,如前所述,更稳定的T状态意味着血红蛋白对氧气的亲和力下降。由于较高的质子浓度对应于较低的pH值,这意味着pH值越低,T状态就越稳定。最终,T状态越稳定,血红蛋白分子对氧气的亲和力就越低;因此,当pH值下降时,pH值起着血红蛋白变构抑制剂的作用。因此,当pH值升高时,会发生相反的效果。这将意味着较低的质子浓度,意味着更难形成盐桥,因此形成速度较慢且不太稳定的T状态。不太稳定的T状态更容易与氧气结合;因此,pH值升高会导致血红蛋白对氧气的亲和力增加。结果是,当pH值升高时,pH值起着血红蛋白变构激活剂的作用。 
**二氧化碳** 或CO2 也是血红蛋白的另一种变构抑制剂。造成这种情况的原因有很多。首先,**碳酸酐酶** 可以帮助二氧化碳与水反应生成碳酸,碳酸会解离成碳酸氢根和质子。因此,在存在足够多的碳酸酐酶的情况下,二氧化碳会导致溶液pH值下降,因为其与水反应会产生大量的质子。如前一段所述,更多的质子意味着更低的pH值,进而意味着血红蛋白对氧气的亲和力下降。二氧化碳还会中和血红蛋白氨基末端(氨基通常以其质子化形式存在于生物系统中)的正电荷。这种电荷中和会导致负电荷的氨基甲酸酯基团的产生,这些基团会形成盐桥,导致血红蛋白T状态的稳定,进而导致对氧气的亲和力下降。因此,二氧化碳是一种有效的血红蛋白变构抑制剂。
波尔效应
[edit | edit source]波尔效应是指血红蛋白的一种性质,即在较低的pH值(更酸性的环境)下,血红蛋白对氧气的结合亲和力会下降。由于二氧化碳与血液中质子浓度直接平衡,血液中二氧化碳浓度升高会导致pH值下降,最终导致血红蛋白对氧气的亲和力下降。
**生理作用** 波尔效应有助于氧气运输。血红蛋白在肺部与氧气结合,并在组织中释放氧气,主要释放给最需要氧气的组织。当组织的代谢率升高时,其二氧化碳产生量也会升高。二氧化碳通过以下反应生成碳酸氢根:
- CO2 + H2O H2CO3 H+ + HCO3−
该反应通常进行得很慢。在碳酸酐酶的帮助下,红细胞中碳酸氢根和质子的形成加速。这会导致组织的pH值下降,并促进氧气从血红蛋白中解离到组织中,从而使组织获得足够的氧气以满足其需求。相反,在肺部,氧气浓度很高。氧气的结合会导致血红蛋白释放质子,质子与碳酸氢根结合,驱使二氧化碳在呼气时排出体外。由于这两个反应密切匹配,血液的pH值变化很小。


2,3-二磷酸甘油酸(BPG)与血红蛋白结合并影响氧气结合:BPG结合在血红蛋白T状态的中心腔中。BPG的阴离子基团位于Hb键和两个β亚基的N末端氨基之间的离子配对距离内。BPG仅与T状态的血红蛋白结合并使其稳定。这将T R平衡向T状态移动,从而降低了O2的结合亲和力。BPG对我们体内O2的运输非常重要。一个例子是高海拔适应。高海拔会导致红细胞中合成的BPG数量迅速增加。BPG数量增加会使氧气结合曲线从海平面位置移至较低的亲和力位置(向右移动)。这会减少肺部对O2的结合量,但更大程度上会增加组织中释放的O2量。因此,血红蛋白可以将更多O2从肺部输送到组织。
镰状细胞会使运输氧气到心脏和身体各部分的血红蛋白细胞改变形状。这使得运输过程不顺利,并会导致疾病。
镰状细胞性贫血
[edit | edit source]影响许多人血红蛋白功能的一种疾病是镰状细胞性贫血,这种疾病是由氨基酸序列中第6位氨基酸的谷氨酸被缬氨酸取代引起的。症状发生在个人几个月大的时候。镰状细胞性贫血的特征是呼吸急促、生长发育迟缓、发烧、黄疸、心跳加速以及许多其他疾病。问题在于这些人的血红蛋白发生了突变。这种突变形式的血红蛋白被称为血红蛋白S,其溶解度低于正常血红蛋白形式。对血红蛋白S结构的检查表明,新的缬氨酸残基位于T状态分子的表面。由于这种改变,脱氧血红蛋白在其表面具有疏水性斑块。疏水性斑块与其他疏水性斑块相互作用,导致分子聚集形成链,这些链排列成不溶性纤维。由于这种突变形式在血液中积累时不能自由移动,因此它们最终会在输送氧气时破坏或扭曲红细胞的形状。红细胞最终会变成镰刀形或新月形。这些受影响的细胞在通过身体循环输送氧气的效率要低得多。它们很容易在较小的血液流动区域阻塞,导致血液流动中断。镰状细胞性贫血不应与血友病混淆,血友病是一种人体不能形成血栓的疾病。如果没有得到适当的治疗,患有这种疾病的人通常会在20到40岁之间死于器官衰竭。更好的技术和关于这种疾病的数据导致了治疗方法的出现,这些方法包括叶酸补充剂,这些补充剂可以激活新的健康红细胞的生成。治疗必须持续进行,目的是限制疼痛和紧急情况的数量。总体免疫系统也会受到这种疾病的影响,因此人们经常服用抗生素和疫苗来防止生病。
镰状细胞性贫血是遗传的,只有父母双方都患有这种疾病,孩子才会患上镰状细胞性贫血。大约每12个非洲裔美国人中就有1人具有这种特征。镰状细胞性贫血高发地区与疟疾高发地区之间存在显着相关性。患有镰状细胞性状的人对疟疾有抵抗力,因为携带这种疾病的寄生虫在其生命中的某个阶段需要生活在红细胞中,而它无法在镰状细胞中存活。因此,由于自然选择,随着时间的推移,患有镰状细胞性贫血的人数增加了,因为在疟疾还没有治愈方法之前,大多数感染疟疾的人都会死亡。现在可以在怀孕期间诊断出镰状细胞性贫血。建议患者多喝水、吸入足够的氧气、对感染迅速做出反应。应避免剧烈的体力活动,应避免吸烟,也应避免过度暴露在阳光下。镰状细胞性贫血的严重后果无疑包括死亡,但其他后果包括失明、脾脏功能障碍、组织坏死、中风和急性胸痛。以下是健康红细胞与受镰状细胞性贫血影响的红细胞的对比图片。
地中海贫血
[edit | edit source]就像镰状细胞性贫血是单个氨基酸的差异一样,地中海贫血也是一种遗传性疾病,会导致血红蛋白链的减少或缺失。这会导致血红蛋白水平降低,患有这种疾病的人会患上贫血、疲劳、皮肤苍白以及脾脏和肝脏功能障碍。地中海贫血分为两种类型:α-地中海贫血和β-地中海贫血。在α-地中海贫血中,血红蛋白的α-螺旋供应不足。这使得血红蛋白对氧气的亲和力很高,没有协同作用,因此氧气在组织中的释放很差。这是由于16号染色体上的4个等位基因的破坏造成的,这种情况比较罕见。在β-地中海贫血中,β-链供应不足。额外的α-螺旋会聚集并在红细胞内沉淀,导致贫血。β-地中海贫血是由11号染色体上两个等位基因的破坏引起的。
一氧化碳中毒
[edit | edit source]一氧化碳(CO)是一种危险的气体,因为它无色无味。一氧化碳的来源包括运行的汽车和燃气设备。吸入后,它会与氧气在相同的部位结合,并会对人体吸收氧气的能力产生负面影响。一氧化碳与血红蛋白的结合能力是氧气的200倍。即使在低分压下,一氧化碳也会阻止血红蛋白将氧气输送到体内。一旦一氧化碳与血红蛋白的一个部位结合,血红蛋白就会转变成R状态,这会增加氧气的亲和力,并防止氧气在组织中解离。
一氧化碳中毒的治疗包括在较高分压下吸入100%的氧气。由于压力较高,这将使大多数一氧化碳从血红蛋白中置换出来。
吸入 100% 的氧气有助于减少 COHb(一氧化碳血红蛋白)的半衰期,COHb 是红血球中 CO 和血红蛋白形成的稳定复合物,CO 的存在会导致这种复合物的形成。测量红血球中 COHb 的水平可用于确认是否接触过 CO,并评估中毒的严重程度。对于非吸烟者,COHb 水平超过 2% 被认为是升高的;对于吸烟者,则超过 9%。
CO 会取代血红蛋白中的氧气,从而切断组织和细胞的氧气供应,这会导致成年人出现神经系统问题,儿童出现学习障碍和发育问题,以及孕妇流产。
CO 中毒的症状并不明显,包括头痛、头晕、恶心、疲劳和虚弱。这些症状可能被误诊为食物中毒、流感、偏头痛或药物滥用。
CO 中毒主要有两种类型:急性中毒,由短时间内暴露于高浓度 CO 中引起;慢性或亚急性中毒,由长时间内暴露于低浓度 CO 中引起。
CO 中毒对人体系统的影响
- 神经系统:中枢神经系统抑制,轻度病例会导致头痛、头晕,严重病例会导致昏迷、癫痫发作。
- 心脏:心肌功能下降、血管扩张,以及心肌氧气输送和利用减少,会导致胸痛、低血压、心率加快。
- 代谢:轻度病例出现过度换气,严重病例出现代谢性酸中毒。
- 肺:急性病例中 10-30% 会出现肺水肿。
- 多器官功能衰竭:发生在高浓度 CO 中毒的情况下。
胎儿血红蛋白是主要的氧气运输蛋白。它在发育的最后 7 个月内产生,并在出生后 8 个月内保持。
胎儿血红蛋白
[edit | edit source]
胎儿从母体的肺部获取氧气。母体血液中的氧气附着在红血球中的血红蛋白分子上,并在胎盘处扩散到胎儿的血液中。当血液到达胎儿时,压力会低很多,这对于正常的成年人来说是不够的。
在整个胎儿形成过程中,会产生三种不同类型血红蛋白,后一种血红蛋白会使其前一种血红蛋白失活。所有三种类型都具有相同的血红素分子和铁原子,但在结构上略有不同。在前八周,大部分血红蛋白是一种称为胚胎血红蛋白的类型。血红蛋白的产生随后由胎儿血红蛋白(**血红蛋白 F**)接管。它是胎儿发育过程中表达的主要血红蛋白形式。血红蛋白 F 在受孕后几周出现,直到出生后几个月才消失。在怀孕的第 35 周左右,成人血红蛋白(**血红蛋白 A**)开始产生。最终,血细胞中只包含血红蛋白 A,这是人类一生中唯一产生的血红蛋白。
成人血红蛋白和胎儿血红蛋白之间的结构差异
从结构上看,成人血红蛋白由 4 个血红素基团、2 个**α**链和 2 个**β**链组成。胎儿血红蛋白(也称为血红蛋白 F)也由 4 个血红素基团、2 个**α**链和 2 个**γ**链组成。γ 链被称为 γ 亚基,与成人血红蛋白的 β 链同源。此外,胎儿血红蛋白和成人血红蛋白在 2,3-BPG 结合位点附近存在差异。2,3-BPG 与胎儿血红蛋白的脱氧形式的结合程度不如与成人血红蛋白的脱氧形式的结合程度。
此外,另一种称为血红蛋白 A2 的血红蛋白,由两个**α**和两个**δ**珠蛋白链组成,在儿童期和成年期以少量产生。血红蛋白 A2 占血红蛋白总量的 2-3% 左右。
血液兴奋剂
[edit | edit source]还有一种激素可以诱导红血球产生增加。促红细胞生成素是一种糖蛋白激素,它控制红细胞生成,也称为红血球产生。它是一种红细胞前体在骨髓中的蛋白信号分子(细胞因子)。这种激素由肾脏的间质成纤维细胞和肝脏的窦周细胞产生。
参考文献
[edit | edit source]生物学,第八版。皮尔逊,本杰明·卡明斯,2008 年。
伯格,杰里米。生物化学。第 7 版。W.H. 弗里曼公司,2011 年。
大卫·海姆斯,尼格尔·胡珀。生物化学。第三版。纽约。泰勒和弗朗西斯集团,2005 年。
http://www.mdconsult.com/das/article/body/305467842-2/jorg=journal&source=&sp=20829759&sid=0/N/818895/s0735675707006584.pdf?issn=0735-6757 http://www.testbreath.com/carbon_monoxide_in_breath.asp https://www.atsdr.cdc.gov/toxprofiles/tp201-c7.pdf http://obitet.gazi.edu.tr/makale/makale/internalcombustionengines/060.pdf http://www.physio-control.com/uploadedFiles/learning/clinical-topics/Detecting%20Carbon%20Monoxide%20Poisoning%20in%20the%20Emergency%20Dept.pdf http://sickle.bwh.harvard.edu/hbsynthesis.html



