结构生物化学/MPS1 蛋白激酶抑制剂开发
外观
< 结构生物化学
MPS1 基因是在一种称为酿酒酵母的出芽酵母中发现的。该基因(MPS1)在克隆后最初被称为 RPK1,但由于 MPS1 是在首次出版物中使用的名称,因此它一直保留下来 [1]。在早期,通过使用谷胱甘肽 S-转移酶标记的 MPS1,证明 MPS1 是一种蛋白激酶,这导致了其他常见激酶底物的强烈自磷酸化和底物磷酸化。对原始酵母 MPS1 突变体进行了表型分析,结果确定了激酶的许多关键功能。
MPS1 蛋白激酶参与有丝分裂的不同步骤,例如染色体附着和在中心体处的功能。此外,它们参与发育和有丝分裂后的多种信号通路。这个庞大的 MPS1 蛋白激酶家族可以通过一个保守的 C 末端结构域来识别,即使 N 末端结构域不同,该结构域也存在于所有 MPS1 蛋白激酶中。有丝分裂中 MPS1 蛋白激酶的过度表达在癌症生长中发挥作用,并导致 MPS1 蛋白激酶抑制剂的发现和开发。
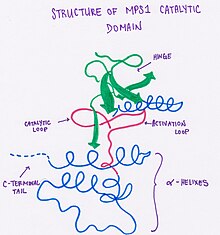
这种蛋白质具有双叶结构,其中 N 末端由一个五链 β 片和一个 α 螺旋组成。在 MPS1 中,存在一个额外的 β 链。蛋白质的两个叶片通过 Glu603-Gly605(铰链环)连接。C 末端由一个两链 β 片组成,在该叶片旁边是七个 α 螺旋,催化环和活化环。发现聚乙二醇(用于蛋白质结晶)存在于激酶的催化部分,并形成了其他激酶中不存在的第二个口袋。这种独特的特征可以潜在地用于创建针对这种激酶的特异性抑制剂。
