结构生物化学/膜蛋白
膜蛋白是任何在生物膜中发现的蛋白质。它们参与各种生物过程,例如细胞信号转导途径。膜蛋白在控制各种梯度方面也起着重要作用,例如化学梯度、电梯度和机械梯度,并在细胞分裂等关键细胞事件中负责细胞结构。由于它们在膜中的多种功能,它们在膜表面高度集中。它们也可以作为通道,将特定分子进出膜。这些蛋白质根据蛋白质与膜相互作用的强度分为两大类。
以下列出了两大类:
- 整合蛋白:(也称为内在蛋白)这些蛋白质的特征是与膜的强相互作用,这种相互作用只能通过添加去垢剂或其他非极性溶剂来破坏。从本质上讲,它们永久地与膜结合。它们可以跨越整个磷脂双分子层,也可以是单拓扑的。

整合蛋白。 - 外周蛋白:(或外在蛋白)是与膜相互作用比整合蛋白弱得多的蛋白质。这些连接往往更暂时,可以通过用极性试剂处理来置换。
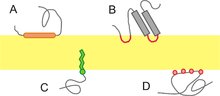
外周蛋白。
还有一种膜蛋白的分类方法。它来自膜蛋白,例如 colicin A 和 α-溶血素。这些蛋白不适合整合或外周分类。在这个分类的替代系统中,膜蛋白分为整合蛋白和两亲蛋白。

生物膜具有磷脂双分子层结构,其中包含一组蛋白质,这些蛋白质帮助质膜执行其独特的功能。膜蛋白可以附着到细胞或细胞器的膜上,或与之相关。膜蛋白可以根据它们与膜结合强度的不同分为两组
一些膜蛋白被发现结合到脂质双分子层上,通常参与细胞间信号传递或相互作用。另一些则嵌入细胞的脂质双分子层中,通常形成通道和孔隙。膜蛋白可以附着在细胞膜的外部和内部。
蛋白质可以通过多种方式附着到细胞膜上。一种方法涉及不可逆的共价修饰。Ras(一种 GTP 酶)和 Src(蛋白质酪氨酸激酶)都已知以这种方式被修饰。这两种蛋白质都参与信号转导途径,但当共价连接脂质基团时,它们就会附着到细胞质膜的内表面。当 Ras 和 Src 固定到细胞膜时,它们能够更好地接收和传递通过其各自的信号转导途径传递的信息。膜蛋白可以由α螺旋或β折叠组成,也可以由α螺旋和β折叠的组合组成。例如,称为孔蛋白的通道蛋白完全由β折叠构成,而称为前列腺素的酶蛋白完全由α螺旋构成。
膜蛋白可以是α-螺旋或β-折叠。蛋白质可以通过α螺旋跨越膜。跨膜α-螺旋是膜蛋白中最常见的结构基序。对一级结构的检查表明,膜蛋白中大多数氨基酸是非极性的,极少是带电的。发现的第一个 α-蛋白质之一是细菌视紫红质。它利用光能将质子从细胞内部转运到外部,从而产生用于形成 ATP 的质子梯度。七个α-螺旋紧密堆积,排列垂直于细胞平面,跨越 45A 宽度。膜蛋白也可以由β折叠构成。β折叠形成通道蛋白。它们不如α-螺旋常见。通道蛋白是由β折叠的β折叠排列形成的。每条链与其相邻链以反平行排列形成氢键,形成一个单一的β折叠。然后 β折叠卷曲形成一个空心圆柱体,在膜中形成一个通道。一个例子是孔蛋白。外表面是非极性的,与膜的烃链核心相互作用,而内部通道是亲水的,充满水。极性和非极性排列是通过沿每条β折叠交替疏水和亲水氨基酸来实现的。
许多膜蛋白具有由多个亚基组成的四级结构。膜蛋白中的这种寡聚化有利于其功能、稳定性、遗传效率,甚至可能优化膜单位面积的生产力。细胞色素 b6f 作为四级结构影响膜蛋白功能的一个例子。这种蛋白质包含两个亚基,它们通过一个桥连接在一起,以便电子可以在它们之间转移。关于稳定性,如果在一个亚基上发生稳定性改善的突变,则由 2、3 或 4 个亚基组成的四级蛋白质将分别稳定 2、3 或 4 倍。对所有四级蛋白亚基由 1 个基因编码,而不是每个亚基由不同的基因编码,这在遗传上将更有效。通过这种方式,可以以最小的遗传空间编码四级蛋白。这方面的一个例子是跨膜的离子通道。这些四级膜蛋白的整体是由重复的、相同的亚基堆叠在一起形成的。然后,每个亚基(以及因此整个离子通道)都由 1 个单一基因编码并翻译而来。此外,寡聚化还可以有助于最大限度地提高功能输出,因为它允许膜蛋白紧密地堆积在脂质双分子层区域内,而不会以能量不利的方式与其他蛋白质接触。[1]
在许多癌细胞中观察到 Ras 和 Src 的突变;据认为,这些突变以及随后的信号转导途径中断会导致细胞不受控制的复制。当检测到突变的存在时,一种名为泛素的小蛋白质会附着在受损的蛋白质上;这种修饰表明标记的蛋白质将被破坏。重要的是在后期之前破坏蛋白质,这样受损的 DNA 不会传递给其他细胞。泛素附着在受损蛋白质上是细胞凋亡(程序性细胞死亡)的第一步。[编辑] 整合蛋白
如前所述,整合蛋白(也称为内在蛋白)与膜牢固地结合并永久结合。这些蛋白质的一个或多个部分嵌入膜的磷脂双分子层中。它们表现出与膜的强烈相互作用,因为它们的氨基酸残基包含疏水侧链,这些侧链与磷脂双分子层的疏水内部(脂肪酰基)相互作用。由于它们与膜的疏水核心的强烈疏水相互作用,因此这些蛋白质只能使用去垢剂、非极性溶剂或有时是变性剂从膜中分离出来。最后,重要的是要注意,整合蛋白占基因组中编码的蛋白质的很大一部分。
整合蛋白有两大基本类别。
这些蛋白质跨越整个膜。它们是整合蛋白中最常见的。

它们可以只穿过膜一次或多次,在膜中穿梭。跨膜蛋白有两种类型:α-螺旋和β-桶。
前者是两者中更为常见的,可以在细菌细胞的内膜或真核生物的质膜中找到。电压门控离子通道,如钾通道和氯通道,是α-螺旋跨膜蛋白的例子。它们主要由疏水性氨基酸残基组成,很少有亲水性残基,例如带电和极性残基。主链中的极性羰基氧不向螺旋外突出,而是指向内部,促进和加强螺旋内的氢键。范德华力将跨膜区域的三级和四级结构连接在一起。这些相互作用允许结构的灵活性以适应必要的功能。在 TM 主链中发现的最常见的两种极性残基是丝氨酸和苏氨酸,它们可能与螺旋主链形成氢键。这种氢键作用将极性侧链捕获在疏水环境中,例如脂质双层。极性侧链反过来又与其他螺旋形成氢键。两种残基,甘氨酸和脯氨酸,被称为水中的螺旋破坏者,它们在螺旋中形成折痕,在功能机制中起着重要的作用。[2]
β-桶存在于革兰氏阴性菌的外膜、革兰氏阳性菌的细胞壁、线粒体和叶绿体的外膜中。孔蛋白是β-桶跨膜蛋白的例子。它们穿过细胞膜,充当分子可以扩散的孔道。跨膜蛋白可以进一步分类为 I 型和 II 型。在 I 型中,N 末端位于膜的外侧。在 II 型中,C 末端出现在膜的外侧。

VDAC(电压依赖性阴离子通道)是线粒体外膜中发现的一种跨膜蛋白的例子,它为底物扩散提供孔道。VDAC 由 19 个 β-折叠组成,形成 β-桶,以及一个部分 α-螺旋链,在该单元中共有 20 个链。β-桶的第一个和最后一个 β-折叠是平行的,而中间的折叠是反平行的。[3]
VDAC 的亚型 1,事实上,在去污剂胶束和双层体中的三个高分辨率结构最近已从溶液核磁共振和 X 射线晶体学中发表。这有助于解决 VDAC 的膜拓扑结构,并提供第一个真核 β-桶膜蛋白结构。这种跨膜蛋白的不同之处在于它具有平行 β-折叠配对和奇数个折叠。研究为 VDAC 的电压门控机制及其受 NADH 调节提供了结构和功能基础。自 VDAC-1 的从头结构和另外六种蛋白质以来,过去两年中通过溶液核磁共振发现的跨膜蛋白结构数量已翻了一番。[4]
单拓扑蛋白
[edit | edit source]这些蛋白质永久地与膜结合,但仅从一侧结合。许多这些蛋白质是酶。例如,环氧合酶和肉碱 O-棕榈酰转移酶。前者是一种参与前列腺素形成的酶。阿司匹林和布洛芬等抗炎药通过抑制这种酶来缓解炎症和疼痛的症状。后者是一种线粒体转移酶,参与棕榈酰肉碱代谢为棕榈酰辅酶 A。
外周蛋白
[edit | edit source]外周蛋白,也称为外在蛋白,缺乏与磷脂双层的疏水内部的相互作用。由于它们缺乏与膜的疏水相互作用,因此它们比整合蛋白更容易从膜上分离。外周蛋白的解离可以通过用高 pH 或高盐浓度溶液处理来实现。相反,外周蛋白通过静电和其他非共价力附着在膜上。通常,它们要么通过与整合蛋白相互作用间接附着在膜上,要么通过与磷脂的极性头部(两亲性)直接相互作用。一些外周蛋白表现出这两种类型的相互作用。这些包括某些激酶和 G 蛋白。外周蛋白的其他例子是离子通道和跨膜受体的调节蛋白亚基。膜蛋白功能
转运蛋白
[edit | edit source]由于脂质双层的性质,许多分子由于尺寸或电荷而无法进入或离开细胞。膜蛋白的功能是帮助这些分子穿过脂质双层。跨膜蛋白参与被动运输或主动运输。
泛素和膜蛋白转运
[edit | edit source]ER 插入脂质双层会导致新合成的跨膜蛋白被分类、转移和定性维持。这个过程由泛素化控制,泛素化是一种蛋白质翻译后修饰,与蛋白质生物合成递送至质膜有关。可以通过分泌途径跟踪此过程。泛素化还可以用来调节通过内吞途径从质膜中删除蛋白质。跨膜蛋白的泛素化通常足以将质膜蛋白内吞靶向。但是,仍然存在某些功能,例如分类和降解,这些功能完全需要泛素。
这种对特定膜蛋白的控制和改变是由于泛素改变了整合膜蛋白的质量或数量。作为副作用,该过程中的缺陷也会导致诸如囊性纤维化等有害疾病。
泛素修饰可以影响货物运输、分泌/内吞途径中质量控制/维护机制。
泛素在内质网膜转运和质量控制中的作用
[edit | edit source]泛素转化不会影响 ER 预先执行的调节作用。然而,在内质网相关降解过程或 ERAD 中,泛素活性会在泛素连接酶的需要下启动。此过程很重要,因为它负责去除未正确折叠的蛋白质。接受此过程的底物被重新定位到细胞质中,等待被去除。ERAD 靶点首先被泛素化,并且必须与蛋白质 Ubx(一种泛素结合蛋白)协商。此过程表明,ERAD 底物的泛素化提供了一个信号,该信号对于将蛋白质靶向降解是必需的。这表明泛素在蛋白质膜蛋白转运中起着至关重要的作用。重要的是要注意,ERAD 功能还提供了关键的质量保证方面。此过程中的一个错误可能会导致有害的副作用;这意味着 ERAD 程序经过仔细监控,因此可以确保膜蛋白的转移质量。
泛素在蛋白质质量控制中调节蛋白质膜蛋白组成
[edit | edit source]发现 ERAD 可以影响和加强 ER 和高尔基体之间的通讯。这可以通过降解 ER 的保留因子来实现。在胆固醇耗竭条件下,细胞被泛素化并降解。这表明蛋白质离开 ER 并被送入高尔基体进行包装。相反,高尔基体中的 GAT 蛋白包含三个可以很好地结合泛素的表面。这导致泛素成功结合,并加速了 GAT 蛋白从高尔基体转移到 ER。此外,聚合蛋白货物和泛素为蛋白质膜的定位提供了必要的驱动力。
泛素在质膜蛋白周转中的作用
[edit | edit source]在酵母的内吞作用中,泛素几乎是所有过程所必需的。酵母内有足够的泛素供应是有益的。酵母中存在的蛋白质货物的内化通常都是泛素介导的。
质膜蛋白包含一种由蛋白质自身因素驱动的保护机制。质膜也限制了错误折叠蛋白质的数量。在生命周期中,质膜蛋白会对错误折叠蛋白质的数量进行限制和调节。这种质量检查表明,这些特定的蛋白质必须控制膜整合蛋白以及受损和错误构建蛋白的去除。尽管对化学过程的理解有限,但质量维护机制通常必须包括以下功能:修复或重新折叠受损蛋白质的能力,以及区分健康和受损蛋白质的能力。
与细胞质或水性环境中的蛋白质一样,蛋白水解过程对细胞质和脂双层中的细胞功能至关重要。然而,膜内蛋白酶与水溶性蛋白质相比,面临着不同的挑战。科学家一直在研究方法来破译膜内蛋白酶家族的分子机制。特别是,Site-2 膜内金属蛋白酶和丝氨酸膜内蛋白酶 rhomboid 具有共同的特征。这两个蛋白酶家族的活性位点都位于膜中。然而,为了有效切割膜蛋白或任何其他蛋白质,必须引入水来水解肽键。这些蛋白酶通常识别特定的残基序列,从而在特定位点切割蛋白质。为了将水引入切割位点,存在一个将水性环境连接到切割位点的递送系统。
分子被允许沿着浓度梯度流动。在大多数情况下,这不需要特殊的蛋白质。然而,在协助扩散中,不溶于脂双层或太大而无法通过的分子通过特殊的转运蛋白的协助穿过细胞膜。协助扩散的例子包括氨基酸和离子。

其他类型的被动运输,不需要蛋白质,因为分子直接通过细胞膜扩散,包括渗透、扩散和过滤。

单向转运蛋白是在被动运输中移动分子的蛋白质。它们可以是通道蛋白或载体蛋白。通道蛋白响应刺激打开,并让分子自由地流过。载体蛋白与分子结合,使其具有足够的疏水性以穿过膜。下图显示了两种类型的单向转运蛋白及其功能。
能量被消耗来将分子向上运输穿过浓度梯度。主动运输有两种类型:初级主动运输和次级主动运输。两者都涉及利用 ATP 逆浓度梯度运输,但它们在蛋白质如何使用 ATP 上有所不同。
ATP 被消耗来将分子向上运输穿过浓度梯度。一个例子是钠钾泵,它将两种离子都逆浓度梯度泵出,以产生膜电压势。
在次级主动运输中,ATP 没有直接与目标分子偶联。相反,另一个分子被向上运输穿过浓度梯度,从而产生一个电化学梯度。然后,目标分子沿着电化学梯度被运输。虽然这个过程仍然消耗 ATP 来产生梯度,但能量没有直接用于将分子跨膜移动,因此被称为次级主动运输。
次级主动运输中涉及两种主要的蛋白质类型:反向转运蛋白 和 协同转运蛋白.
- 反向转运蛋白
- 分子在相反方向移动。一种类型的分子进入细胞,而另一种类型的分子离开细胞。一个例子是钠钙交换蛋白,它从细胞中移除钙离子,同时允许钠离子返回。钠离子被钠钾泵泵出,从而产生这种过程所需的浓度梯度。
- 协同转运蛋白
- 分子在相同方向移动。这通常通过允许离子沿着其电化学梯度移动来实现。另一个分子搭载这种移动并逆其浓度梯度移动。
膜蛋白的流动性 生物膜是柔性的。这种柔性是通过蛋白质的流动性实现的。流体镶嵌模型允许称为横向扩散的横向运动,有时也会发生横向扩散或翻转,这需要更长的时间。
横向扩散 是脂类横向移动,速度很快,除非受到特殊相互作用的限制。

翻转或 横向扩散 是指分子从一个膜表面过渡到另一个膜表面的情况。与横向扩散相比,它是一个非常慢的过程。每隔几个小时才会发生一次。
尽管在膜蛋白的研究方面取得了许多进展,但人们对环境在决定膜蛋白结构或功能方面的作用知之甚少,因为这些蛋白质很容易受到环境变化的影响。主要问题仍然在于难以创造一个促进蛋白质天然功能和结构的环境。然而,对流感病毒,更具体地说对 M2 蛋白的研究进展,为这一复杂挑战提供了更多见解。
M2 蛋白是一种同四聚体,具有三个功能域:N 末端、TM 螺旋和 C 末端。在最近的发现之前,药物有效地阻断了 TM 螺旋,从而阻止了质子传导功能,进而使病毒失活。然而,随着最近 H1N1 病毒和猪流感暴发的发生,该蛋白质的结构在三种不同的环境中被仔细研究,每种环境使用不同的方法。通过比较这三种获得的结果,可以观察到环境对蛋白质的影响。第一种成像技术,固态核磁共振,得出结论,M2 在脂双层环境中是稳定的。后来添加了药物金刚烷胺,使蛋白质呈现四重对称结构,进一步表明在金刚烷胺存在的情况下更稳定。
第二种图像,晶体结构,不仅比较了不同 pH 值下的结构,而且还表明膜蛋白可以获得一系列构象状态。
最后,由溶液核磁共振生成的第三种图像得出结论,膜蛋白的氨基酸相互作用以最小化静电势,并且当存在水时,允许氢键交换。对该蛋白质的进一步筛选仍在进行中,在环境对蛋白质结构的影响的研究中,还有很多东西有待揭示。然而,很容易理解为什么这个话题仍然是一个重要且受欢迎的话题。通过了解环境对膜蛋白的影响,研究人员能够开发药物来抑制,例如,流感病毒。即使是 H1N1 病毒等突变也能被禁用,只要研究人员对它们的膜蛋白以及它们如何被环境改变和操纵有关键的理解。对 M2 蛋白的研究最终将导致对其他膜蛋白以及它们如何被环境变化改变有更深入的了解。
膜在人体中起着最重要的作用。它强烈地影响着每个结构环境。每当我们谈论膜时,我们必须提及蛋白质结构,因为它们相互关联。蛋白质也被称为氨基酸,在我们的身体中发挥作用。膜和氨基酸是人体中帮助我们保持生命的主要功能。它们相互支持,在身体内部的每个部位形成正确的结构和序列。
人体内存在不同类型的膜,每种膜都具有不同的结构和功能,这些结构和功能也与氨基酸相关。例如,跨膜蛋白存在于异质环境中,这对现有结构方法构成了重大障碍。每种结构可以在不同的环境中发挥作用,并且键的连接方式也不同。很难获得支持膜蛋白的天然结构、动态和功能的膜模拟环境。膜蛋白通常需要使用去垢剂来模拟天然脂双层环境。为了成功了解它们在哪个环境中发挥作用,我们必须了解键的结构。键在每种结构中都非常重要,因为它将元素和一个或多个结构连接在一起。但是,了解如何断裂键和形成新键也很重要。这就是了解键角和键稳定性非常有帮助的原因。此外,通过了解键结构,科学家可以研究不同类型的疾病以及治愈所有疾病的药物。脂双层是一种薄膜。脂双层在表征膜蛋白的天然结构和验证在其他膜模拟环境中确定的结构方面具有独特的作用。
事实上,许多蛋白质是膜蛋白,它们在细胞中发挥作用。细胞需要与外部环境进行交流或穿过细胞膜。许多进入膜的蛋白质是与糖蛋白相关的。蛋白质很难研究,因为它们的结构和功能非常复杂。然而,一些蛋白质的功能是可以预测的。
膜蛋白的研究一直受到 X 射线晶体学难以检测这些蛋白质的困扰。到目前为止,科学家们已经能够通过对膜中蛋白质进行计算模拟来研究膜成分之间的相互作用细节及其相对功能。膜蛋白稳定性的问题困扰着科学家们。一项特别困难的任务涉及研究不同状态之间的可逆转变。这些相互作用已经过热力学研究,并产生了关于螺旋-螺旋相互作用和膜蛋白稳定性方法类型的相关信息。蛋白质和脂质之间的稳定性已通过模拟方法进行模拟,例如模拟将特定氨基酸侧链埋入双层中的自由能成本。原子模拟使得这些努力成为可能,包括揭示关于复杂膜蛋白(如离子通道)的信息。
研究膜蛋白的困难主要归因于处理蛋白质的困难以及与膜蛋白工作相关的实验挑战。此外,为了对系统有适当的理解,对孤立的蛋白质分子和分子环境进行共同研究使得研究变得更加困难。例如,从生物系统中剩余成分中分离蛋白质对于结构测定至关重要。但为了进行任何适当的热力学分析,它必须包含系统的所有相关成分,尤其要注意能量交换的边界。
传统上,在研究膜蛋白时,科学家会在制备过程中去除膜蛋白周围的脂质。现在,科学家们认识到脂质作为结晶的重要添加剂的重要性。目前,科学家们在分析过程中添加脂质后,在解决膜蛋白结构方面取得了更大的成功。这些成功导致越来越多的膜蛋白结构与脂质分子结合变得清晰可见,并可以进行分类。
膜蛋白复合物
[edit | edit source]膜蛋白组装成复合物,这些复合物允许这些错综复杂的组装实现使用单一多肽无法实现的复杂性。这些复杂的组装允许膜蛋白具有许多涉及调节机制和化学反应的功能。这些膜蛋白复合物的存在可以防止潜在的问题,例如不必要的相互作用、聚集或有害中间体的形成。此外,这些复合物在机械上是宝贵的,因为它们遵循一个过程,其中复合物的一部分是“预制的”,并且在损坏时被单独替换,这意味着如果只有一个亚基损坏,则不需要替换整个复合物。膜蛋白复合物已通过蓝原生聚丙烯酰胺凝胶电泳和分裂泛素方法进行了分析。
膜蛋白复合物允许通过以有序的、甚至顺序的方式组装来避免上述问题(不必要的相互作用、聚集或有害中间体的形成)。为了了解这些复合物的形成是有序的,需要知道组装中间体是什么。因此,蛋白质越大,越难暴露形成顺序。然而,较小的复合物,如大肠杆菌 bo3 复合物,使科学家能够理解膜蛋白复合物遵循线性的组装路径。bo3 复合物由四个亚基组成,这些亚基通过两个中间复合物组装而成。人们理解 bo3 线性组装是因为虽然可能形成其他中间体导致 bo3 的形成,但它们没有被观察到,并且只存在一条组装路径,表明中间体遵循顺序的有序路径。非线性组装将是显而易见的,因为将存在几种不同的组装路径。有序形成在细胞分裂中的分裂体中也可见,如果缺少一种蛋白质,所有下游蛋白质将无法正常相互作用。科学家认为,这种有序途径的存在是为了保护细胞免受潜在有害中间体的伤害。
伴侣蛋白在这些复合物的形成中也发挥着重要作用。伴侣蛋白充当物理组装因子,与蛋白质相互作用并防止发生非生产性的相互作用。例如,伴侣蛋白防止酵母 F1F0-ATP 合酶的 F1 复合物中发生聚集。与α和β亚基结合的两个伴侣蛋白与疏水界面结合,并将α和β亚基引导到 a3b3 复合物组装中。研究还表明,某些中间体中伴侣蛋白的缺失可能是膜蛋白复合物活化的原因。重要的是,中间体必须保持非活性状态,以防止部分组装的复合物发生不受调节的活性。
人们认为膜蛋白复合物会经历动态交换,作为一种调节复合物内受损亚基的机制。动态交换允许将新导入的蛋白质组装到复合物中以替换受损的蛋白质,而无需替换整个复合物。这在光系统 II 叶绿体中可见,其 D1 亚基会受到光损伤,并作为其修复机制的一部分被替换。动态交换最初仅在体外进行。科学家只能得出结论,动态交换是一种可能的修复机制,但无法得出结论,它实际上是在体内发生的。直到使用荧光显微镜,科学家才能够证实动态显微镜确实在一定程度上发生了。荧光显微镜标记了蛋白质并观察了它在体内的相互作用。观察到亚基自由扩散进入和离开复合物。未来的研究希望能揭示哪些蛋白质正在交换,以及为什么这些蛋白质会经历动态交换。[5]
在文章“膜蛋白结构:预测与现实”中,Arne Elofosson 和 Gunnar von Heijne 讨论了目前用于预测膜蛋白插入和折叠的几种技术;他们对这些技术的使用方式和局限性进行了现实而务实的描述。他们还指出了这些技术中尚未解决的主要问题。
Arne 和 Gunnar 首先指出α-螺旋束和β-桶是膜蛋白的两种主要结构。虽然螺旋束约占所有开放阅读框的 20% 到 25%,但桶状结构只占所有开放阅读框的百分比。一个开放阅读框。(一个阅读框指的是可以分成三个字母的密码子并被转录成蛋白质的 DNA/RNA,而一个开放阅读框指的是在阅读框中不包含终止密码子的 DNA 序列。)螺旋束和β-桶之间的相似之处在于,为了适应膜中脂双层的基本结构,它们都在蛋白质的中间包含疏水性氨基酸。两者之间的主要区别在于它们的二级结构。螺旋束是一种复杂的、长跨膜蛋白,它包含多个α-螺旋;而β-桶蛋白包含几个β-折叠卷起,它比α-螺旋束更短,疏水性更低。Arne 和 Gunnar 指出,螺旋束形式受到了更多的关注,因为它们更长,因此比β-桶更容易识别。
Arne 和 Gunnar 描述了螺旋束和 β 桶是如何合成并插入脂质双层的。在螺旋束转运的情况下,相应的核糖体首先与转运蛋白结合,转运蛋白是一种位于内膜的蛋白质,负责将蛋白质转运穿过内细胞膜进入周质,称为 SecYEG 转运蛋白。螺旋束被翻译并插入内膜。根据螺旋束的疏水性,螺旋束之间的相互作用会有所不同;一次可以合成一个螺旋束或多个螺旋束。β 桶由于其疏水性低于螺旋束,无法独自穿过内膜;在细胞质中翻译后,它在 SecA ATPase 的帮助下通过 SecYEG 转运蛋白与 SecB 结合并转移到周质。它通过 YaeT 异源寡聚体外膜整合复合物插入外膜。在膜蛋白插入脂质双层后,人们认为螺旋束之间的相互作用比与脂质的相互作用更强,因此螺旋束相互紧密排列并获得其构象。极性侧链之间的氢键也参与了蛋白质的构象形成。螺旋束和 β 桶在插入膜后会达到相对稳定的构象。然而,一些膜蛋白表现出更高的灵活性,例如负责质子或电子转移的那些。
根据 Arne 和 Gunnar 的说法,在螺旋束膜蛋白的情况下,一级结构,即其氨基酸序列长期以来被用来区分螺旋束膜蛋白和其他蛋白。由于脂质双层具有疏水性,因此插入这种脂质双层的螺旋束应该包含疏水残基。两种重要的氨基酸,色氨酸和酪氨酸,其侧链含有芳香结构,有助于螺旋束膜蛋白的疏水性。螺旋束也必须足够长才能跨越内膜;因此,一个螺旋束可以平均包含 10 到 20 个疏水残基。环连接螺旋;根据环是面向细胞内部还是外部,环包含不同的氨基酸组成。
人们一直认为膜蛋白是垂直穿过膜的,Arne 和 Gunnar 指出,膜蛋白的方向可能更复杂。导致膜蛋白复杂性意外增加的一个因素是重入环,如谷氨酸转运蛋白的情况所示。关于 β 桶,Arne 和 Gunnar 概括了一系列推断出的结构原理;例如,β 折叠具有偶数并以反平行方式倾斜约 45 度。
结构预测
[edit | edit source]Arne 和 Gunnar 调查了一系列拓扑结构和结构预测方案,其复杂性逐渐增加。二维预测是最早的技术;这种技术利用跨膜蛋白比环区更高的疏水性,并且一直是一种有效的工具。二维预测面临的一个挑战是,来自信号肽和跨膜螺旋的拓扑基因数据相似,因此难以区分两者。在预测 β 桶膜蛋白的结构时,科学家会寻找是否存在 N 末端信号肽以及蛋白质的总体氨基酸组成。预测 β 桶膜蛋白的结构比预测螺旋束的结构更简单,因为其氨基酸序列更短,而且不像那么明显。
如前所述,膜蛋白不能简单地建模为全部垂直穿过膜;重入环是一个重要的特征,它增加了膜蛋白的复杂性。Arne 和 Gunner 建议,这些重入环可以通过一种名为 2.5D 预测的最新开发的拓扑技术来预测。这些重入环中的残基,包括长环、中长环和短环,通常比蛋白质的其他部分更小,因此很容易在跨膜螺旋之间找到。2.5D 膜蛋白结构预测基于蛋白质所包含的氨基酸序列类型或预测残基距离膜蛋白中心的距离来预测结构。可以预测的残基特征包括脂质暴露(疏水)区域或脂质埋藏残基以及脯氨酸引起的弯曲。由于 2.5D 预测能够包含膜蛋白的亚结构,例如界面螺旋和重入环,因此它有助于对膜蛋白进行分类。
3D 结构预测最初是通过低分辨率实验(如电子显微镜)进行的。Arne 和 Gunnar 指出,与所有其他针对 3D 预测测试的球状蛋白一样,膜蛋白的 3D 预测精度较低。导致膜蛋白 3D 预测难度增加的原因是,它们在与球状蛋白不同的环境中维持其结构;此外,已成功预测的球状蛋白远小于感兴趣的膜蛋白。迄今为止,可用于测试的 3D 模型有限,但已经有一些模型被提议用于测试。其中之一是同源建模,这可能会导致具有原子水平细节的结构,其质量与针对球状蛋白测试的模型相似。[6]
SNARE 蛋白
[edit | edit source]在 膜运输中的未解之谜 这篇由斯坦福大学生物化学系 Susanne R. Pfeffer 撰写的论文中,她解释了关于蛋白质如何在细胞内穿梭并帮助促进运输的不同假设,但目前还没有完全得到证实的假设。首先,可溶性 N-乙基马来酰亚胺敏感因子附着蛋白受体蛋白,也称为 SNARE 蛋白,有助于促进囊泡与其目标膜的融合。SNARE 蛋白有两组截然不同的类型。第一组是 R-SNARE,也称为 v-SNARE 组,位于囊泡上。第二组 SNARE 蛋白是 Q-SNARE,也称为 t-SNARE,因为它位于目标膜上。这两类蛋白的主要区别在于,R-SNARE 在囊泡上只作为单个蛋白质存在,而 Q-SNARE 则会形成三个 Q-SNARE 的复合物。在这些类别下,特定的 R-SNARE 蛋白会与特定的 Q-蛋白配对。关于这两者如何配对以促进高尔基体囊泡与细胞表面的融合,目前尚不清楚,但我们可以将其想象为 SNARE 蛋白就像拼图一样,因为它们具有特定的特异性,因此一个 SNARE 蛋白(R-SNARE/v-SNARE)将只与一个特定的 SNARE 复合物(Q-SNARE/t-SNARE)结合。尽管科学家仍然不知道高尔基体如何决定运输这些囊泡,但 R-SNARE 和 Q-SNARE 为到达了什么和可能离开了什么提供了线索。如果某个特定位置存在 Q-SNARE 的浓度,则可以通过观察该位置之前是否存在融合活动来解释。现在,当我们观察 R-SNARE 时,有两种可能的答案解释了它们为何存在于某个特定位置,一种可能是因为它们最近到达并且刚刚发生融合,另一种可能是因为一个囊泡即将离开高尔基体膜。需要注意的是,反式高尔基体中的膜运输量小于顺式高尔基体中的膜运输量,这一点可以通过观察反式高尔基体边缘的 SNARE 浓度较低,而顺式高尔基体边缘的 SNARE 浓度较高来证明。因此,有了所有这些新想法,我们必须寻找具体的答案,以更好地理解细胞内的膜运输是如何发生的。[7]
参考文献
[edit | edit source]- ↑ http://www.ncbi.nlm.nih.gov/pubmed?term=Introduction%20to%20the%20membrane%20protein%20reviews%3A%20the%20interplay%20of%20structure%2C%20dynamics%2C%20and%20environment%20in%20membrane%20protein%20function
- ↑ NCBI, 溶剂化环境对膜蛋白结构的影响,2012 年 11 月 19 日
- ↑ Hiller, S., Abramson, J., Mannella, C., Wagner, G., and Zeth, K., "VDAC 的 3D 结构代表一种天然构象", Trends in Biochemical Sciences, 2010.
- ↑ 溶液 NMR 在 VDAC-1 和其他膜蛋白结构测定中的作用。Sebastian Hiller 和 Gerhard Wagner*
- ↑ 膜蛋白组装成复合物,作者:Daniel O. Daleya,于斯德哥尔摩大学生物膜研究中心,生物化学与生物物理学系,瑞典斯德哥尔摩,邮编:106 91,2009 年 6 月 5 日。
- ↑ 膜蛋白结构:预测与现实。Annu Elofsson A, von Heijne G. Rev Biochem. 2007.76:125-40
- ↑ 膜运输中的未解之谜:Annu. Rev. Biochem. 2007. 76:629–45 Pfeffer, Suzanne R. 斯坦福大学生物化学系
8. http://www.annualreviews.org/doi/pdf/10.1146/annurev-biochem-060210-093619


