结构生物化学/分子几何
分子几何
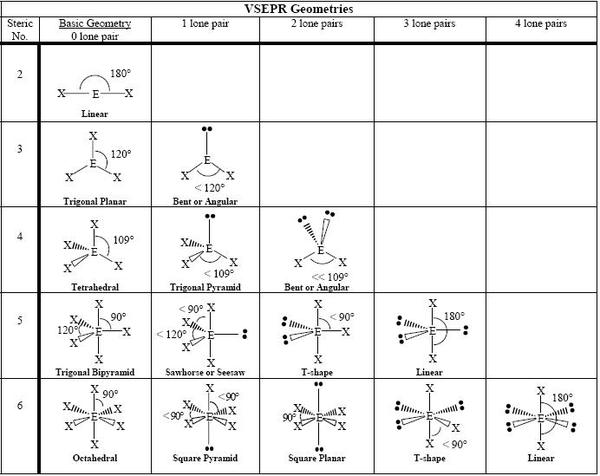
分子几何是指分子在空间中占据的三维形状。它由中心原子和周围原子以及电子对决定。大多数分子的形状可以使用价层电子对互斥 (VSEPR) 方法预测。该方法提出了一些规则,可以帮助人们在不使用 X 射线晶体学、核磁共振波谱法或电子显微镜等高科技方法的情况下确定物质的形状。一些最常见的形状包括线性、三角平面、四面体、锥体和角形(或弯曲)。
价层电子对互斥 (VSEPR) 理论:中心原子周围的电子对会以尽可能远地彼此分离的方式排列。价层是原子最外层被电子占据的壳层,它容纳了参与键合的电子。在共价键中,一对电子被两个原子共享。在多原子分子中,几个原子使用两个或多个电子对与中心原子键合。键合中的负电荷电子对或孤对之间的排斥会导致它们尽可能地散开。 "电子对排斥 "的概念可以通过将几个充气的气球系在一起来演示。每个气球代表一个电子对。气球会试图减少拥挤,并尽可能地分散开来。根据 VSEPR 理论,可以通过从中心原子周围的电子对几何形状开始,并向一些或所有电子对添加原子来预测分子几何形状。该模型对于简单分子产生了与实验测定结果非常一致的结果。有了这个模型,就可以用系统的方式确定分子几何形状。然后可以将分子分为两组:第一组:没有孤电子对的分子。在这种情况下,分子几何形状与电子对几何形状相同。第二组:具有一个或多个孤电子对的分子。在这种情况下,需要一个额外的步骤来将电子对几何形状转换为最终的分子几何形状,因为在分子几何形状中只考虑了键合原子的位置。
VSEPR 理论指出
1) 中心原子周围的电子对和原子将赋予分子其形状。
2) 分子中中心原子周围的电子对会尽量彼此远离。
3) 中心原子周围的孤对会对整个分子的形状产生影响,就像原子一样。
4) 孤对电子之间的排斥力比孤对和共享对之间的排斥力更强,而孤对和共享对之间的排斥力又比两个共享对(或中心原子与另一个原子之间的键)之间的排斥力更强。
这些只是 VSEPR 理论的一些基本假设,这些假设与分子的路易斯点结构一起,使我们能够确定其将具有的形状。
许多有机化合物含有碳原子或其他原子(如氧或氮)的环。最简单的环状化合物包含 3 个碳原子,如环丙烷。最常见的环状化合物包含 5 个或 6 个碳原子。这些化合物也被称为环状化合物。
由 4 个等距的 sp3 杂化轨道构成的分子,形成大约 109.5o 的键角。轨道的形状是四面体。两个轨道包含孤对电子。连接到中心原子的两个原子形成一个具有弯曲形状的分子。
原子杂化与其几何形状之间存在着简单的关系,即其他原子如何在空间中围绕它排列。本模块考察了代表元素 B、C、N、O 和 F 的允许键合模式,以及它们的几何形状与其杂化和形式电荷的关系。
**寻找杂化** 对于分子的杂化:1. 计算价电子总数 2. 除以 8,如果 e- 数量 > 8。除以 2,如果 e- 数量 ≤ 8。
分子的几何形状决定了许多性质,如极性、反应活性、状态等等。极性与形状直接相关,因为许多具有极性键的分子由于分子的对称性而可能成为非极性分子,这种对称性具有相等的向外或向内电子拉力。二氧化碳就是一个例子。碳的两侧都有负电性的氧原子,氧原子将原子拉向自己,导致每个末端出现部分负电荷,而负电性较低的碳则带部分正电荷。氧原子都与碳双键,没有孤对电子使分子弯曲,分子是线性的,键角为 180 度。由于部分负电荷的大小相等且方向完全相反,因此两个部分负电荷的拉力相互抵消,整个分子是非极性的。

另一方面,一个分子可以具有极性键和不同的形状,这种形状不能平衡负电性的拉力。例如,过氧化氢分子,它也含有三个原子,但形状不同。水是四面体形状的弯曲形状,因为它有两个额外的电子对,它们将氢原子推到 109.5 度角。因此,氧原子上的部分负电荷在两侧平衡,但指向向上和向内,使整个分子具有极性。

反过来,极性本身会影响许多性质,如熔点、沸点、蒸气压、溶解度以及可以形成的键的类型,这只是一些例子。极性分子由于分子之间的吸引力而具有更高的熔点和沸点以及更低的蒸气压。极性分子也往往溶解其他极性分子,而非极性分子也溶解其他非极性物质。这通常被称为 "相似相溶",这是一种记忆这种性质的简便方法。
分子几何形状决定的另一个性质是反应活性。反应活性在许多方面受到影响。一个例子是分子根据极性形成的键的类型。例如,一些极性分子可以在氢键中反应,而非极性分子可以在伦敦色散力中反应。但还有其他一些方法,即几何形状直接影响分子参与的反应部位。体积大的分子通常使用未受阻碍的一侧反应,即使它不是最有利的产品,因为反应更容易。另一个例子是酶及其根据自身的形状和底物的形状 "适应" 特定的底物的方式。这些只是分子形状如何帮助确定反应活性的众多例子中的两个例子。

虽然 VSEPR 和一些类似的方法可以用来确定分子的几何形状,但有一些高科技方法可以毫无疑问地显示出我们比以往更大分子(通常是蛋白质)的形状。这些方法包括 X 射线晶体学、核磁共振波谱法和电子显微镜。X 射线晶体学由于波长非常接近原子间键的波长,因此具有非常高的分辨率,因此是最好的方法之一。
该方法的第一步是将蛋白质转化为晶体,这可以通过添加某些盐来实现,这些盐会使大分子结晶。一旦蛋白质以晶体形式存在,就会用X射线束照射它,并观察光线的变化。一些光会被吸收,一些会被散射,一些会被衍射。所有射线都被仔细研究,它们的信息,例如振幅,为生物化学家提供了有关分子中原子信息的。

另一种技术叫做核磁共振谱,它允许在蛋白质结构被转化为晶体之前进行研究。它是少数几种允许在溶液中研究物质的方法之一,通常在CDCl3中。由于元素的磁共振,常用的两种NMR是质子NMR和碳NMR。对于H-NMR,当一个分子暴露在磁场中并且质子被激发并排成一行时,可以观察到四件事,它们告诉我们每个相同质子组的环境。化学位移(信号下移多少)告诉我们哪些官能团包围了质子。信号积分给我们一个比例,比较了每个家族中质子的数量。分裂(一个信号中峰的数量,例如双峰、三峰等)告诉我们有多少个邻近的氢原子。最后,信号的数量本身告诉我们有多少个不同的质子家族。C-NMR的工作方式相同,除了积分,在C-NMR中积分并不总是像在H-NMR中那样清晰。所以所有这些信息都收集在一个分子中,它的精确连通性通常可以确定,即使它是一个未知的分子。

第三种方法是电子显微镜,它使用电子显微镜,电子显微镜发射电子束。电子束照射大分子,然后在荧光或照相胶片上生成分子及其结构的图像供我们观察。有时它们甚至直接发送到屏幕上,比如电脑屏幕。这张图像是黑白的,但仍然非常有用,可以用来确定结构。
来源
http://chem-guide.blogspot.com/2010/04/valence-shell-electron-pair-repulsion.html
http://www.rcsb.org/pdb/101/static101.do?p=education_discussion/Looking-at-Structures/methods.html
Berg, Tymoczko, 和 Stryer 编著的《生物化学》第六版
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Molecular_Geometry
