结构生物化学/朊病毒蛋白错误折叠和疾病
传染性海绵状脑病(TSE 或朊病毒病)是一组罕见的致命性神经退行性疾病,影响人类和其他哺乳动物。TSE 是蛋白质错误折叠疾病,包括正常宿主朊病毒蛋白异常积累形式的聚集。TSE 的独特之处在于它们具有传染性。TSE 的特征包括它们可以复制,能够进行选择性进化(可以进化出耐药性),具有多种与体内独特表型相关的感染因子菌株,并表现出强烈的种属特异性;这是许多病毒和细菌病原体的相同特征。

人类 TSE 疾病分为 3 类
- 散发型 - 最常见的 TSE 形式(例如克雅氏病)
- 遗传型 - TSE 是朊病毒蛋白内的突变
- 获得性 - TSE 是摄入或接种受 TSE 污染的物质的结果。
-
显微镜下的“孔洞”是朊病毒感染组织切片的典型特征,导致组织形成“海绵状”结构。
典型的感染因子使用核酸来传播和增殖,在细菌和病毒中很明显。朊病毒假说简单地说,上述特定疾病完全由蛋白质引起,这一观点在该理论提出时与当时的常识相悖。起初,人们认为朊病毒是其他类型感染的副作用。然而,这一理论站不住脚。自提出朊病毒诱发疾病的概念以来,实验证据支持了这一理论,朊病毒复制的影响在实验室中已经得到证实。 [1]
朊病毒及其传染性最早是在 1937 年发现的,当时在进行病毒接种时,羊瘙痒病意外地传染给了绵羊。在后来的实验中,羊瘙痒病被有意地传染给绵羊,然后传染给小鼠,以确定该分子的性质。新几内亚的食人行为是库鲁病感染人类的来源,1966 年证明该疾病可以传染给猴子[1]。此时,科学界开始了解到朊病毒的传染性不同于病毒或微生物感染。最近,牛海绵状脑病和与食用受感染肉类相关的变异克雅氏病的爆发被证明是由朊病毒引起的。
从历史上看,对朊病毒的研究首先确定了感染方式是新颖的,然后确定它是由于蛋白质链的错误折叠造成的。第一个实验使用紫外线和电离辐射破坏核酸,发现感染因子仍然存在[1]。然后,确定仍然具有感染性的最小分子量颗粒的重量约为蛋白质的重量。
后来,发现抗蛋白酶的朊病毒蛋白(PrP)浓度与感染性成正比。此外,使用破坏蛋白质结构的试剂,降低了 PrP 的感染性。发现 PrP 存在于正常运作的大脑中,证明该蛋白质既可以以正常形式存在,也可以以故障形式存在[1]。最近,研究表明,感染性和非感染性蛋白质可以混合,感染因子会在非感染性分子中传播。这表明蛋白质折叠错误可以无限期地传播。
TSE 是一种蛋白质错误折叠疾病,疾病发生是由于宿主朊病毒蛋白 (PrP) 的构象发生改变。PrP 是一种哺乳动物糖蛋白,长 209 个氨基酸。当 PrP 变成 TSE 时,在一个称为发病机制的过程中,PrP 的一种抗蛋白酶敏感形式 (PrP-sen) 会重新折叠成 PrP-res(一种抗蛋白酶的朊病毒蛋白形式)。PrP-res 和 PrP-sen 具有相同的初级序列,但二级结构不同,PrP-sen 具有更多 α-螺旋。(换句话说,PrP-res 和 PrP-sen 是同种型)PrP-res 是 TSE 的主要成分。因此,研究 PrP-sen 如何转化为 PrP-res 非常重要,以便抑制 PrP-res 形式的形成。
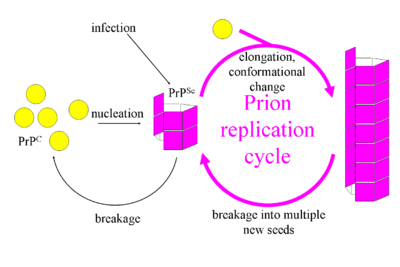
目前对 PrPc 到 PrPSc 转化的了解可以概括为一个两步机制
1) 前体“种子”PrPSc 的有序聚集体与 PrPc 结合。
2) PrPc 经历某种构象变化,导致其传播成更多 PrPSc。这一步的机制在很大程度上是一个谜。转换后的 PrPSc 被添加到聚合物中,该聚合物最终会断裂并导致更多 PrPc 被转换。这种断裂被认为是反应的限速步骤。 [1]
2001 年,开发了一种在实验室复制朊病毒的方法。这种方法被称为蛋白质错误折叠循环放大 (PMCA),体外产生模拟体内正常复制的朊病毒。该过程依赖于朊病毒是自催化的,在正确环境下可以无限期地复制。这种技术被证明对研究朊病毒和检验朊病毒假说非常宝贵。 [1]
科学家们目前还不清楚辅助因子在朊病毒复制过程中的重要性。虽然现在已经了解到有一些外部因素会影响朊病毒复制的成功率和速度,但这些辅助因子尚未完全确定,并代表着未来研究的一个领域。
关于辅助因子在朊病毒复制中作用的证据来自对动物对象的各种研究。在一项对转基因小鼠进行的研究中,发现存在某种影响朊病毒蛋白表达的因子。这被称为“蛋白 X”,尽管该因子的身份从未被确定为一种蛋白质。 [2]. 在一项对仓鼠 PrPc 进行的独立研究中。当分离和纯化时,仓鼠 PrPc 在与 PrPSc 混合时无法转化。当向样品中加入脑匀浆时,朊病毒转化发生,表明匀浆中存在某种物质有助于转化,无论是作为催化剂还是作为组成部分。进一步测试表明,仓鼠中的 RNA 充当朊病毒复制的催化剂,但在小鼠中则不然。具体是如何做到这一点尚不清楚,但有可能它有助于稳定所产生的 PrPSc 的构象。它并非对所有哺乳动物都有效这一事实导致了多种辅助因子的可能性,或者物种/器官特异性辅助因子。
虽然辅助因子的重要性尚未完全了解,但辅助因子可能影响朊病毒转化的方式可分为 5 类。
| 遗传信息 | 可能存在某些辅助因子通过帮助确定这些蛋白质的折叠方式来促进朊病毒复制。一项支持这一观点的研究是在小鼠中进行的,通过将朊病毒注射到不同类型的细胞中。在每个细胞中,朊病毒复制导致不同的朊病毒菌株,这可能是每个细胞类型中不同辅助因子导致的结果。 |
| 催化 | 某些辅助因子可能通过附着在 PrPc 上并部分展开它来催化 PrPc 到 PrPSc 的转化。这将使 PrPSc 更容易在蛋白质上诱导错误折叠模式,导致转化。这种类型的辅助因子在实验室中进行了体外研究。 |
| 构象稳定 | 一些辅助因子可能有助于稳定新的朊病毒构象。这类辅助因子的例子包括核酸、蛋白质、金属离子和其他物质。其中许多是带电物质,可以与朊病毒结合并帮助形成更紧凑的结构。 |
| 片段化 | PrPSc 聚合物通常会片段化,这极大地加速了 PrPc 到 PrPSc 的转化。一些辅助因子可能有助于这一片段化过程,这会产生新的种子,对复制过程至关重要。在酵母中发现了一个例子,它依赖于蛋白质 104 (Hsp104)。去除这种蛋白质会阻止朊病毒复制的发生。 |
| 生物稳定 | 为了成功地进行朊病毒复制,朊病毒必须首先在生物介质中存活下来。某些生物抗性,例如可以进行吞噬作用的小胶质细胞,可以抑制它们的传播。一种降低小胶质细胞破坏这些朊病毒能力的辅助因子将允许它们复制,并且可能被证明是必不可少的。 [1] |
PrP-sen 中氨基酸 108-189 内的一级和二级结构成分被证明对转化很重要,如核磁共振结构和体内研究所确定。PrP-sen 的关键残基 (108-189) 包括大部分折叠域,包括 β 折叠、α 螺旋,最重要的是环和转角。转角和环的轻微变化特别值得注意,因为已经确定环参与 PrP-sen 和 PrP-res 之间相互作用。
虽然对 PrP-sen 三级结构有广泛的了解,但对 PrP-res 却不能这么说。关于转化为 PrP-res 的机制途径缺乏广泛知识的部分原因是 PrP-res 结构未知,因为它尚未被充分纯化以进行高分辨率结构研究。由于无法使用高分辨率技术,确定 PrP-res 结构的重点一直局限于使用低分辨率技术,例如电子显微镜来确定 PrP-res 的超微结构和二级结构。
在酵母中发现了一种有趣的朊病毒案例。虽然它们通常在哺乳动物中观察到,但发现酵母中的一种特定蛋白质 (Ure2) 以典型朊病毒的方式表现和繁殖。然而,它并没有杀死宿主细胞,而是通过诱导其他蛋白质的构象变化而繁殖,并通过细胞分裂遗传。这种特殊情况导致了在真菌中发现其他朊病毒,这些朊病毒也表现出非致死性行为。 [1]
正如在酵母朊病毒的例子中发现的那样,这些错误折叠的蛋白质并非天生具有恶意,也不对有机生命有害。在西南大学科学家进行的一项研究中,发现体内某些朊病毒样蛋白质可能有助于免疫系统。这些线粒体抗病毒信号蛋白 (MAVS) 被发现存在于线粒体膜中,并积极防御病毒感染。研究发现,在受到病毒感染威胁的情况下,MAVS 蛋白会错误折叠并在线粒体表面聚集,有效地保护该细胞器免受攻击。这种有意的错误折叠和聚集很有趣,因为它并不反映朊病毒在克雅氏病和牛海绵状脑病等情况下引起的恶意和不可控的错误折叠。虽然初始病毒检测对系统的顺序激活可能很复杂,但 MAVS 蛋白的聚集实际上发生得很快。 [4]
PrP-res 自身放大的方式与淀粉样蛋白纤维通过从前体蛋白库中种子聚合而生长的方式高度相似。因此,淀粉样蛋白纤维为 PrP-res 生长机制的假设提供了启示。
淀粉样蛋白是纤维状蛋白质聚集体,具有特定的结构特征。淀粉样蛋白纤维的结构具有特征性的交叉β折叠模式,其中β折叠排列形成片层,这些片层垂直于纤维轴,而链之间的氢键平行于纤维轴。虽然这种交叉β四级结构在淀粉样蛋白中是已知的,但尚未确定 PrP 的这种范围内的详细结构,PrP 是迄今为止更大的蛋白质。
与淀粉样蛋白纤维一样,PrP 可以被诱导形成淀粉样蛋白样纤维。一个特别重要的模型是重组肽 PrP23-144。 (重组肽是从其相应的重组 DNA 编码的肽)。PrP23-144 被证明具有高度的构象可塑性 (能够以各种可能的方式改变构象),并且可以被诱导形成多种纤维氨基酸。该模型中 PrP23-144 可以被区分成多种构象可能性,这表明 PrP 同种型转换高度依赖于 PrP-sen 到 PrP-res 之间的结构兼容性 (例如,前面提到的转角和环的变化)。溶剂的选择也起着作用,因为某些结构元素会受到静电或亲水效应的影响。
治疗
[edit | edit source]由于科学家对朊病毒的了解有限,目前还没有针对诊断为朊病毒相关疾病的患者的完全可靠的治疗方法。朊病毒清除的一种可能性是通过小胶质细胞和吞噬作用。也发现地衣具有分解朊病毒的能力。[5] 尽管有很多可能的科研方向,但对于朊病毒相关疾病患者来说,还没有临床解决方案。
检测
[edit | edit source]
在过去十年中,研究已经帮助确定了血液中的 PrPSc。直到现在,还没有可靠的方法来识别脑组织中的这些错误折叠的蛋白质。科学家采用一种称为 SOFIA (环绕光纤免疫测定) 的新方法,能够以高精度 (十亿分之一) 识别脑组织中朊病毒的存在。首先,使用抗体放大并用荧光标记含有 PrPSc 的样品。然后将其放入一个设备中,该设备用可以检测发射光的环绕光纤包围样品。使用激光激发染料,探测器拾取来自样品的发射。
这种方法在以前被认为健康的绵羊身上进行了测试,但最终患上了朊病毒病。分析了它们在出现症状前的血液样本,发现可以非常早地检测到 PrPSc 的存在。虽然这种方法不能治愈或消除任何问题,但它可以用来隔离并极大地降低这些朊病毒传播的风险。[6]
- ↑ a b c d e f g h Soto, Claudio "朊病毒假说:争议的终结?", '[PubMed]', 2010. 2012 年 11 月 20 日检索。
- ↑ Telling GC, et al. “在表达人类和嵌合 PrP 转基因的小鼠中朊病毒的传播暗示了细胞 PrP 与另一种蛋白质的相互作用。”, ‘[PubMed]’, 2012 年 6 月 27 日。 2012 年 11 月 20 日检索。
- ↑ Weissmann C. "关于哺乳动物朊病毒株的想法", '[PubMed]', 2009. 2012 年 11 月 20 日检索。
- ↑ 侯法建等。 "MAVS 形成功能性朊病毒样聚集体以激活和传播抗病毒先天免疫反应", '[Cell]', 2011. 2012 年 11 月 20 日检索。
- ↑ Johnson, Christopher J. 等 "地衣中丝氨酸蛋白酶对疾病相关朊病毒蛋白的降解", '[PLOS]', 2011. 2012 年 11 月 20 日检索。
- ↑ Rubenstein, R., Chang, B., Gray, P., Piltch, M., Bulgin, M.S., Sorensen-Melson, S. & Miller, M.W "在血液中检测朊病毒", '[Microbiology Today]', 2010. 2012 年 11 月 20 日检索。
参考文献
[edit | edit source]- Moore, R (2009) 朊病毒蛋白错误折叠和疾病