结构生物化学/蛋白质功能/抗体
抗体是一种蛋白质,由动物在体内存在外来物质(称为抗原)时合成。它们在免疫系统中起着重要作用,通常存在于血液和其他体液中。抗体由白细胞或更具体地说由 B 细胞产生。有五种抗体亚型,每种都起着自卫作用,以抵抗我们体内的外来物体。抗体是对抗原的反应产生的,这些抗原包括但不限于外来蛋白质、多糖和核酸。抗体识别抗原的一个小部分,称为抗原决定簇或表位。每种抗体都以锁钥模型识别并结合特定的抗原。鉴于抗原数量众多,抗体的选择也同样多样。
抗体是 γ 球蛋白,其氨基酸链上连接有糖基。它们可以被归类为 **糖蛋白**。最基本的形式是免疫球蛋白单体,它只有一个免疫球蛋白单位。抗体也可以以二聚体形式出现,具有两个免疫球蛋白单位,四聚体形式具有四个免疫球蛋白单位,甚至五聚体形式具有五个免疫球蛋白单位。
**免疫球蛋白 G** 是最常见的抗体类型,由 4 条链组成。有 2 条轻链和 2 条重链。两条重链通过二硫键 (S-S) 结合在一起,两条轻链通过二硫键结合到重链上。它们共同形成了一个大致的 Y 形。
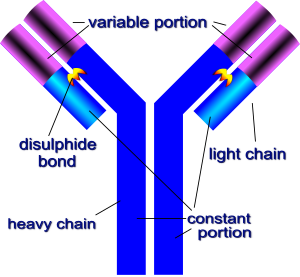
在 Y 形免疫球蛋白的顶部有两个识别并结合抗原的位点。**免疫球蛋白 G (IgG)** 具有相同的通用结构,仅在抗原结合位点有所不同。该区域称为 **可变区 (V)**,由高变环组成。这些高变环赋予抗原结合位点极大的多功能性,使其能够结合多种不同的抗原。**可变区 (V)** 构成两个相同的抗原结合位点,在每种特定类型的抗体中都不同,使这些位点具有特定的形状,适合某些抗原表位。该分子的其余部分由轻链和重链 **恒定区 (C)** 组成,其中这些氨基酸序列在不同抗体之间变化很小。
抗体通过两个过程获得其多样性。第一个阶段称为体细胞或 V(D)J,代表可变、多样化和连接区域,重组。在三个区域中的每一个区域中都位于几组基因。在细胞成熟过程中,B 细胞将从每个区域的多个基因中剪接除一个基因之外的所有基因,并将剩余的三个基因组合在一起以形成一个 VDJ 片段。该片段与一个恒定区域基因一起,构成了随后抗体产生的基础。据估计,考虑到三个区域中每个区域的变异数量,大约可以产生 10,000-20,000 个独特的抗体。
重组的第二阶段发生在 B 细胞被抗原激活后。当抗原与 B 细胞结合时,B 细胞将开始快速繁殖。在此分裂过程中,基因的可变区域将经历快速突变,称为体细胞超突变。这种超突变有助于微调抗体与抗原的结合。对抗原具有更强亲和力的细胞将收到更强的增殖信号,导致逐渐选择对抗原结合最强的抗体。
在 IgG 中,重链有四个亚基,CH3、CH2、CH1(恒定部分)和 VH(可变部分)。轻链有两个亚基,CL 和 VL。两个 CH3 单位直接连接,而 CH2 单位通过寡糖分离。CH1 位于重链的 “铰链” 处,通过二硫键与 CL 单位连接。
由于抗体可以产生数千种变异,因此产生不能正确折叠或无法正常发挥作用的抗体的可能性很高。因此,折叠是抗体生产中非常重要的一步,抗体生产高度依赖于 **内质网 (ER)** 的 “质量控制” 机制。重链和轻链分别合成并在翻译过程中转运到内质网;它们在翻译完成之前就开始折叠。
**Ig 折叠** 是一种高度保守的蛋白质拓扑结构,其在自然界中广泛存在,以至于赋予 **Ig 超家族 (IgSF)** 以其名称,该家族包含含有 Ig 折叠的蛋白质。Ig 折叠由两个反平行 β 折叠组成,总共包含 7 到 9 个 β 链,形成类似三明治的结构。通常,Ig 折叠通过连接两个 β 链并垂直于这些链本身运行的内部二硫键稳定。IgG 的两个可变区域和一个恒定区域都包含 Ig 折叠。Ig 折叠形成过程中的一个重要步骤是脯氨酸异构化。虽然大多数肽键具有 *反式* 构象,但脯氨酸的环状结构意味着它在 *顺式* 构象中只有略微不稳定,并且可以以这种构象存在于自然界中。在 Ig 折叠中的两个 β 链之间存在一个脯氨酸残基,并且该残基从 *反式* 到 *顺式* 构象的异构化通常是 Ig 折叠形成的限速步骤。
虽然最终结构通常非常相似,但 Ig 结构域可以根据其折叠过程大致分为三类。
在第一类中,结构域在内部二硫键的引导下自主折叠,最终状态为单体。在展开的多肽及其天然折叠状态之间存在一个主要中间体。该中间体持续存在一段明显的时间,因为它包含一个 *顺式* 脯氨酸残基,而在最终的折叠状态中,该残基为 *反式*,并且从 *顺式* 到 *反式* 的转变相对缓慢。中间体的中心 β 链几乎完全折叠,小的螺旋连接两对链,使该中间体高度稳定。中间体高度稳定的原因是,小的螺旋在抗体中充当组织中心,它们将体积大的疏水分子定位在蛋白质的中心。这些螺旋最常见于恒定结构域中,而不是在可变结构域中或在容易错误折叠的免疫球蛋白分子中,这表明这些内部连接是抗体折叠的关键。此类别中蛋白质结构域的例子包括轻链的恒定区域 (CL) 和 IgG 的重链的第二个恒定区域 (CH2)。
第二类折叠方式类似于第一类:它形成一个部分折叠的单体,具有一个 *反式* 脯氨酸残基,然后异构化为一个 *顺式* 残基。此时,该结构域无法完成折叠,除非它与自身二聚化。该结构域的代表是 IgG 的重链的第三个恒定区域 (CH3)。在完全形成的 IgG 中,两个重链在该结构域处直接连接(与 CH2 不同,CH2 由糖分离),因此它通过此过程折叠是有意义的。
第三类与前两类有更大的区别。IgG 的重链的第一个恒定区域 (CH1) 无法自主折叠,必须与已折叠的 CL 结合,形成二聚体中间体。与其他两类一样,折叠结构域包含一个 *反式* 脯氨酸残基,必须在折叠完成之前变为 *顺式*。与其他两个过程不同,这种异构化在 CH 与 CL 结合之前无法发生。这导致 CH1 折叠成为所有 IgG 结构域中最慢的折叠;它只有在重链和轻链已经结合在一起后才会发生。
每种抗体的折叠的一个共同点是缓慢的脯氨酸异构化反应,即从反式脯氨酸到顺式脯氨酸的转化。该反应的活化能非常高(约 80 kJ/mol),这使其成为非常缓慢的反应。由于这个事实,脯氨酸异构化反应充当抗体折叠的限速步骤。在这三个类别中的每一个类别中,都存在非常重要的过渡态。限速脯氨酸异构化反应允许反应进行得更慢,并使过渡态被填充,因为脯氨酸必须处于顺式构象才能在折叠过程中继续进行。
B 细胞在产生抗体时会经过一系列的“质量检测”以确保抗体的功能性。在 pre-B 细胞状态下,重链上所有结构域的折叠都会被检测。重链基因重排后,pre-B 细胞会产生 IgM,一种不含轻链的短重链,并与免疫球蛋白重链结合蛋白 (BiP) 结合。BiP 结合于未折叠的 CH1 结构域,该结构域是重链恒定区的一部分。然后,pre-B 细胞会产生一种“替代”轻链,该轻链来自 pre-B 细胞的变异区。如果替代轻链能够诱导 BiP 与 IgM 解离,并且 CH1 结构域能够正确折叠,那么重链就会移至质膜。如果该质量检测失败,IgM 就会作为内质网相关降解 (ERAD) 的底物。因此,该质量检测失败会导致重链降解。当重链形成,并形成常规轻链时,与之前相同的过程会重复进行,常规轻链充当替代轻链。常规轻链必须诱导 BiP 从 CH1 结构域解离,并允许重链 CH1 结构域折叠,以防止抗体进行 ERAD。一旦重链和轻链通过了这两项质量检测,重链和轻链之间就会形成二硫键,抗体随后就可以分泌。
其他状态
[edit | edit source]与大多数蛋白不同,大多数蛋白可以简单地认为存在于特定的折叠形式或变性多肽形式中,而抗体能够在特定条件下形成一些替代结构。例如,在 pH 3 以下,抗体可以存在于一种稳定的形式中,与它们的典型形式不同。虽然这不太可能直接导致任何人类健康问题(血液 pH 值为 3 会在错误折叠的抗体引起任何问题之前就致命),但它会对抗体生产产生影响。工业抗体生产包括在低 pH 值下进行的步骤,这可能会影响最终产品的生产。
另一个与抗体替代状态直接相关的问题是,轻链或截断的重链从 B 细胞中分泌出来,却没有形成完整的抗体。这些片段会聚集并沉积在各种器官中,从而抑制其功能。这种沉积最常见的致命并发症是轻链淀粉样变性,其中单克隆轻链被产生、分泌,并在肾脏中形成沉积物。轻链的变异区更容易形成淀粉样沉积物,这可能是因为其结构需要高度变异,使其更容易逃逸细胞,而不被检测到错误。
功能
[edit | edit source]抗体功能
- 结合外来物体并阻止它们攻击正常细胞
- 在巨噬细胞的帮助下,可以帮助清除病原体
- 可以通过启动补体途径(另一种免疫反应)来直接损伤病原体。
抗体功能的一个例子是血型。例如,血型为 A 的人会产生识别 B 抗原的抗体。如果一个血型为 A 的人接受了血型为 B 或血型为 AB 的输血,识别这些血细胞上的 B 抗原的抗体会导致该人开始凝血。这种现象解释了为什么 AB 型血的人可以接受 A 型或 B 型血的输血,但 A 型或 B 型血的人不能接受 AB 型血的输血。当血液捐献量不足,需要为医疗目的找到匹配血液时,通常会出现这种情况。
五种主要的抗体类别
1)IgM
a.这是一种在首次接触抗原后产生的抗体类别,但之后,其在血液中的浓度会开始下降。免疫球蛋白可以中和抗原,并负责抗原的凝集。因此,它在补体激活方面非常有效。
b.IgM 是一种五聚体。它含有 µ 重链,并与另一种称为 J 链的多肽一起以五聚体的形式存在,J 链负责启动聚合以形成五聚体结构。由于 IgM 具有大量的抗原结合位点,因此每个 IgM 分子可以非常紧密地结合到其表面上具有多个相同抗原拷贝的任何病原体上。这种结合会诱导 Fc 区激活补体途径,最终导致病原体死亡。IgM 还会激活巨噬细胞以吞噬病原体。考虑到这些功能,IgM 是动物对新抗原产生反应时首先产生的抗体,这并不令人意外。
2)IgG
a.这种抗体类别存在于组织液中。它是初次免疫反应后期和继发免疫反应期间血液中最丰富的类别。IgG 促进抗原的中和、凝集和调理,也是唯一能够穿过胎盘的抗体类别。它分泌到母乳中,并被新生动物从肠道吸收进入血液,因此它为胎儿提供了被动免疫。
b.IgG 是一种单体。
3)IgA
a.IgA 通过中和抗原以及凝集来防御黏膜。这种抗体存在于唾液、眼泪、母乳、黏液以及肺部和肠道的分泌物中。母乳中的 IgA 也为哺乳婴儿提供了被动免疫。
b.IgA 是一种二聚体。
4)IgE
a.当 IgE 被触发时,肥大细胞、嗜碱性粒细胞会释放组胺和其他引起过敏反应的化学物质。IgE 存在于组织中,在那里它会结合抗原。其中一些会反过来激活白细胞(称为嗜酸性粒细胞)杀死各种类型的寄生虫。然而,肥大细胞也会释放具有生物活性的胺类,包括组胺,这会导致血管扩张和通透性增加,从而导致过敏反应(如花粉症和哮喘)的症状。
b.IgE 是一种单体
5)IgD
a.在抗原刺激的 B 细胞增殖和分化中,IgD 作为抗原受体发挥作用。这种抗体类别存在于未接触过抗原的幼稚 B 细胞的外部。
b.IgD 是一种单体。
此外,抗体被证明非常出色,因为它们可以阻断体内特定的蛋白质合成,而不会伤害人体细胞。这是因为细菌和真核细胞的核糖体结构存在差异。细菌和人类核糖体的形状有非常具体的差异,这在开发仅针对细菌核糖体以阻止其蛋白质合成的抗生素时非常方便。如果成功,抗生素应该结合并干扰细菌中蛋白质合成起始复合物的形成,或对细菌信使 RNA 的转录产生一些影响。试图开发这些抗生素的科学家成功地利用了核糖体的这些结构差异,试图创造出停止细菌核糖体功能而不影响其所在的人类的方法。例如,线粒体细胞含有类似于细菌的核糖体,而宿主线粒体的真核细胞则具有完全不同的核糖体结构。因此,抗生素可以靶向线粒体中类似细菌的核糖体,而不会损害真核细胞本身,这只是一个微不足道的例子,证明了结构和特异性在药物开发中可以发挥的作用。[1]
抗病毒抗体
[edit | edit source]抗体靶向病毒的功能位点。抗体无法靶向功能位点通常会导致抗体无法抵抗病毒变异。如果无法靶向功能位点,则第二个目标应该是宿主分子(而不是病毒编码的分子)。抗体与目标的天然配体越相似,抗体越有效。
产生双特异性抗体
[edit | edit source]抗体治疗是一种宝贵的疾病治疗方法,部分原因是它们对靶蛋白的选择性。然而,由于某些疾病具有多种不同的机制,因此存在一些缺点。双特异性抗体 (BsAb) 创造了一种有趣的可能替代方法,具有更大的优势。这些抗体可以有效地靶向两个不同的结合位点。一些优势包括逃避治疗的可能性有限,肿瘤靶向性更高以及更有效的细胞毒性选择性。BsAb 的主要缺点是生产难度大。通过单链可变片段双特异性抗体、串联双特异性抗体、二合一抗体和双可变结构域抗体等新技术已经出现在抗体生产中。尽管这些技术存在过于频繁的给药或偶联问题。
CovX-Bodies 是一种基于醛缩酶催化抗体的技术。这使得能够快速生成具有适当靶向性的所需抗体。CovX 体由两个共价结合的药效团组成。它们连接到支架抗体的 Fab 臂中第 93 位的赖氨酸上。它们是通过将支链氮杂环丁烷酮连接体与醛缩酶抗体中的肽药效团异二聚体混合而产生的。肽负责功能活性,而抗体则起到改善半衰期和分布特性的作用。这些抗体能够以特定的结合亲和力、效力和药代动力学特性生成。CovX-Body,CVX-241 目前正在利用血管生成素-2 (Ang2) 和血管内皮生长因子 (VEGF)。该药物在啮齿动物和非人灵长类动物中显示出令人印象深刻的药代动力学特性。异种移植模型显示出有效的疗效。CVX-241 正在完成 1 期临床试验。
参考文献
[edit | edit source]- ↑ 美国国立卫生研究院,“细胞内部”,2005 年,第 10 页
1. Buchner J, Feige M, Hendershot L. “抗体如何折叠。” *生物化学趋势。* **35** (4): 189-198.
2. Colman,Peter M. “新抗病毒药和耐药性”,Walter 和 Eliza Hall 医学研究所
3. David Hames,Nigel Hooper。生物化学。第三版。泰勒和弗朗西斯集团,纽约,2005 年。
4. Venkata R. Doppalapudi 等人。“双特异性抗体的化学生成。” *《美国国家科学院院刊》* **107** (52): 22611.full#ref-list-1。Richard A. Lerner。2010 年 11 月 9 日。CovX。2011 年 11 月 30 日。
