结构生物化学/蛋白质功能/结合位点
结合位点是蛋白质上的一个位置,它与一个相对较小的传入分子(称为配体)结合。
在蛋白质中,结合位点是三级结构上的小口袋,配体通过弱力(非共价键合)与之结合。只有少数残基真正参与配体的结合,而蛋白质中的其他残基则充当框架以提供正确的构象和取向。大多数结合位点是凹形的,但凸形和平坦的形状也存在。
配体结合位点是蛋白质上的化学特异性和亲和力位置,它与其他分子和离子或蛋白质配体结合或形成化学键。蛋白质和配体结合的亲和力是蛋白质和配体之间的化学吸引力。因此,不同的配体可能竞争蛋白质的相同结合位点,化学反应将导致结合和非结合配体之间的平衡状态。结合位点的饱和度定义为单位时间内被配体占据的结合位点的总数。高亲和力配体具有较高的分子间力,能够停留更长的时间,因为它具有较低的浓度,并导致受体发生变化。
最常见的酶结合位点模型是诱导契合模型。它不同于更简单的“锁钥”理论,因为诱导契合模型指出酶的底物不能完美地契合结合位点。“锁钥”模型假设底物是一个相对静止的模型,它不改变其构象,只是完美地结合到活性位点。根据诱导契合模型,酶的结合位点与其对应底物的过渡态互补,而不是正常的底物态。酶通过使其 NH3+ 残基稳定过渡态底物的负电荷来稳定这种过渡态。这导致完成预期反应所需的活化能急剧降低。然后,通过让反应更快地达到平衡,底物被转化为其产物。
蛋白质对我们的身体很重要。蛋白质是由肽键连接的氨基酸链。通过理解蛋白质功能,我们可以解决我们体内不同的问题,因为蛋白质是主要的生物成分之一。为了理解蛋白质功能,将有四个主要研究方向,例如:结构、结合、催化和转换。然而,如果我们了解蛋白质结合,这些想法将更容易理解。蛋白质结合在生物化学中起着极其重要的作用。蛋白质结合通常是可逆的,可以根据其结构和活性而稳定或不稳定。此外,这也是蛋白质结合会影响药物在体内生物半衰期的原因。事实上,许多科学家试图对结合结构进行实验和研究,以发现疾病及其破坏方法。
蛋白质结合和未结合分数(表示为未结合药物浓度与药物总浓度的比率),取决于几个因素。它取决于药物对蛋白质的亲和力、结合蛋白的浓度以及药物浓度与结合蛋白浓度的比率。
蛋白质结合对于血红蛋白和肌红蛋白也至关重要。血红蛋白参与其他气体的运输。此外,它还携带一些身体的呼吸二氧化碳,其中 CO2 与珠蛋白结合。血红蛋白表现出蛋白质三级结构和四级结构的特征。血红蛋白主要由蛋白质组成,这些蛋白质反过来又由氨基酸序列组成。肌红蛋白存在于肌肉组织中,它是第一个被揭示其三维结构的蛋白质。尽管血红蛋白存在于血液中,而肌红蛋白存在于肌肉中,但它们通过功能以及氧气的传递和运输而相互联系。
互补性 分子识别取决于酶的三级结构,它在活性/结合位点创造独特的微环境。这些特殊的微环境有助于结合位点催化。
灵活性 三级结构允许蛋白质适应其配体(诱导契合),并且对于生物化学功能的多样性至关重要(灵活性程度因功能而异)。灵活性对于生物化学功能至关重要。
表面 结合位点可以是凹形的、凸形的或平坦的。对于小配体 - 裂缝、口袋或空腔。催化位点通常位于域和亚基界面。催化位点通常发生在域和亚基界面。
非共价力 非共价力也是结合位点的特征。这些特征是:高于平均水平的暴露疏水表面(小分子 - 部分凹形和疏水),以及水的置换可以驱动结合事件,以及弱相互作用可以导致伙伴的轻松交换。
亲和力 酶对底物的结合能力(可以绘制成底物的分压增加与亲和力增加的图表)。
酶抑制剂是结合到酶并导致其活性降低的分子或化合物。抑制剂可以结合到酶并阻止底物进入酶的活性位点和/或阻止酶催化化学反应。抑制剂有两种类别。
- 不可逆抑制剂
- 可逆抑制剂
抑制剂也可以天然存在,并参与代谢调节。例如,抑制剂引起的负反馈可以帮助维持细胞的稳态。其他细胞酶抑制剂包括特异性结合并抑制酶靶点的蛋白质。这对于消除有害酶(如蛋白酶和核酸酶)很有用。此外,许多不同的合成物质能够抑制酶。例如,氟化膦酸酯(即沙林、VX)不可逆地结合到胆碱酯酶,导致体内乙酰胆碱积累。此外,药物(如 MAOIs(单胺氧化酶抑制剂))可逆地结合到单胺氧化酶,允许单胺神经递质的积累,这在治疗某些疾病方面很有用。
competitive inhibition, the inhibitor and substrate compete for the enzyme (i.e., they can not bind at the same time).[58] Often competitive inhibitors strongly resemble the real substrate of the enzyme. For example, methotrexate is a competitive inhibitor of the enzyme dihydrofolate reductase, which catalyzes the reduction of dihydrofolate to tetrahydrofolate. The similarity between the structures of folic acid and this drug are shown in the figure to the right bottom. Note that binding of the inhibitor need not be to the substrate binding site (as frequently stated), if binding of the inhibitor changes the conformation of the enzyme to prevent substrate binding and vice versa. In competitive inhibition the maximal velocity of the reaction is not changed, but higher substrate concentrations are required to reach a given velocity, increasing the apparent Km.
不可逆抑制剂与酶共价结合,导致酶的活性位点发生化学变化,并且无法逆转。不可逆抑制剂的主要作用包括修饰酶活性所需的关键氨基酸残基。它们通常包含反应性官能团,如醛、烯烃或苯磺酸酯。这些亲电子基团能够与氨基酸侧链反应形成共价加合物。氨基酸成分是包含亲核侧链(如羟基或巯基)的残基,如丝氨酸、半胱氨酸、苏氨酸或酪氨酸等氨基酸。
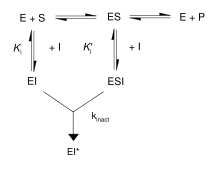
首先,不可逆抑制剂与酶形成可逆的非共价复合物(EI 或 ESI)。然后,这种复合物反应生成共价修饰的不可逆复合物 EI*。EI* 的形成速率称为失活速率或 kinact。可以通过与底物或第二个可逆抑制剂竞争来阻止不可逆抑制剂的结合,因为 EI 的形成可能与 ES 竞争。
此外,一些可逆抑制剂可以通过与靶酶紧密结合形成不可逆产物。这些紧密结合的抑制剂表现出类似于共价不可逆抑制剂的动力学。如图所示,这些抑制剂以低亲和力 EI 复合物迅速结合到酶上,然后缓慢重排成非常紧密结合的 EI* 复合物。这种动力学行为被称为慢结合。慢结合通常涉及酶在抑制剂分子周围“闭合”的构象变化。它稍微改变形状以容纳底物,足以使反应在动力学上向前进行。这些慢结合抑制剂的一些例子包括重要的药物,如甲氨蝶呤和别嘌呤醇。
基团特异性试剂
基团特异性试剂通过与氨基酸上的特定侧链反应来失活酶。一个例子是碘乙酰胺与半胱氨酸侧链反应,完全失活酶,并在此过程中产生 I- 和 H+ 离子。另一个例子是二异丙基氟磷酸 (DIPF) 通过与乙酰胆碱酯酶中关键的丝氨酸侧链反应来失活酶。
反应性底物类似物(亲和标记)
亲和标记对酶上的结合位点具有特异性。它们以底物的形式共价结合到活性位点,从而修饰关键的侧链并抑制酶的活性。例如,溴乙酰磷酸在三磷酸甘油醛异构酶 (TPI) 的活性位点结合。共价键合抑制酶活性,因为活性侧链(即谷氨酸)不再活跃。
机制型抑制剂(自杀抑制剂)
机制型抑制剂在初始底物已与酶结合并经过正常催化机制后才影响酶。催化通常会产生一个中间体,该中间体共价抑制酶。
可逆抑制剂以非共价方式结合到酶上。根据酶的结构以及抑制剂结合到的位置,可能会发生许多不同类型的抑制。抑制剂和酶之间的非共价相互作用包括氢键、疏水相互作用和离子键。许多这些弱键组合起来产生强烈的特异性结合。与底物和不可逆抑制剂相反,可逆抑制剂在与酶结合时通常不会发生化学反应,并且可以通过稀释或透析轻松去除。
可逆抑制剂有三种类型
1)竞争性
2)混合性
3)非竞争性/混合性
- **竞争性抑制剂**,顾名思义,与底物竞争同时结合到酶上。抑制剂对酶的活性位点具有亲和力,底物也结合到该位点。这种抑制可以通过增加底物浓度来克服,以克服抑制剂。竞争性抑制剂的结构通常与底物相似。这些抑制剂会增加 Km。File:Competitive inhibitor.docx
氧阴离子孔稳定四面体中间体。它是通过将肽 NH 基团与带负电荷的氧原子连接的氢键形成的。步骤 3:当底物羰基氧上的负电荷不稳定时,会导致四面体中间体坍塌,碳重新形成双键,从而破坏碳与氨基酸基团之间的肽键。胺离去基团被 His57 质子化,促进其位移。步骤 4:胺组分从酶中分离(被身体代谢),完成第一阶段(酶的酰化)。第一个产物已制成。步骤 5:添加一个水分子。步骤 6:一个进入的水分子被酸碱催化去质子化,产生强亲核性的氢氧根离子。氢氧根对酰化酶的酯键的攻击产生第二个四面体中间体。步骤 7:四面体中间体的坍塌形成第二个产物,羧酸根阴离子,并置换 Ser195。步骤 8:羧酸被释放,酶重新形成以催化下一个反应。
- **非竞争性抑制剂**与酶的底物同时结合到酶上。然而,抑制剂的结合会影响底物的结合,反之亦然。这种类型的抑制无法克服,但可以通过增加底物浓度来减少。抑制剂通常遵循变构效应,即它与酶上与底物不同的位点结合。这种与变构位点的结合会改变酶的构象,从而降低底物对活性位点的亲和力。这些抑制剂会降低 Km 和 Vm。File:Uncompetitive inhibition.docx
- **混合抑制**抑制剂可以与酶底物同时结合到酶上。如果底物浓度高于抑制剂,那么这种类型的抑制可以减少。File:Mixed inhibition.docx
- 非竞争性抑制剂能够结合到 E 和 ES,但它们对这两种酶形式的亲和力不同。因此,这些抑制剂会增加 Km 并降低 Vmax,因为它们会干扰底物结合并阻碍 ES 复合物中的催化作用。
- 非竞争性抑制剂对 E 和 ES 的亲和力相同。它们不会改变 Km,但会降低 Vmax。

