结构生物化学/蛋白质功能/血红蛋白

血红蛋白存在于红细胞中,能够有效地将氧气从肺部输送到身体的组织。血红蛋白还有助于将二氧化碳和氢离子输送回肺部。
血红蛋白能够与气态一氧化氮 (NO) 以及 O2 结合。当红细胞经过肺部的毛细血管床、鳃(在鱼类中)或其他呼吸器官时,氧气扩散到红细胞中,血红蛋白结合 O2 和 NO。然后,血红蛋白在毛细血管中卸载其货物。在那里,O2 能够扩散到体细胞中。NO 放松毛细血管壁,使其扩张,这也有助于将 O2 输送到细胞中。
血红蛋白由四个亚基组成,每个亚基都有一个称为血红素基团的辅因子,该辅因子具有一个铁原子中心。铁是实际与氧气结合的主要成分,因此每个血红蛋白分子能够携带四个 O2 分子。血红蛋白分子四个亚基之间的合作对于 O2 的有效运输是必要的。血红蛋白的四个亚基实际上是协同地 结合氧气的,氧气与四个亚基中的一个位点的结合会增加其余位点与氧气结合的可能性。
血红蛋白是一种蛋白质,用于将氧气从肺部通过血液输送到组织。这对生存至关重要。血红蛋白对氧气的亲和力越低,氧气浓度就越低。这对人体有重大影响,帮助我们非常有效地适应。亲和力越低,浓度越低意味着当我们锻炼时,我们体内氧气含量低,这意味着血红蛋白对氧气的亲和力更低,更容易将氧气释放到人体组织中。这在我们依赖氧气的状态下为我们提供了更多的氧气。另一方面,当氧气浓度很高时,血红蛋白对氧气的亲和力更高,因此不会将氧气释放到不需要的地方。这是一个非常复杂且智能的系统,已经进化了很长时间,使血红蛋白成为重要的生物分子。另一方面,血红蛋白的表亲肌红蛋白用于在肌肉中储存氧气。这种肌红蛋白对氧气的亲和力略高于血红蛋白,尤其是在较低水平时。这是因为肌红蛋白的工作相对容易,它只需要储存氧气并将其释放到肌肉中,而血红蛋白还需要运输氧气并在正确的地方释放它。
血红蛋白由 DNA 编码,就像所有其他蛋白质一样。血红蛋白的改变或突变会导致许多与血液相关的疾病,例如镰状细胞性贫血,其中细胞结构扭曲,不再像正常血细胞那样能够以正确的方式携带那么多氧气。这突出了结构生物化学中结构决定功能的根本理念。镰状细胞性贫血的情况非常有趣,因为它向我们展示了疾病如何以及为何发展。镰状细胞性贫血的基因也提供对疟疾的保护。因此,在疟疾流行的国家,携带镰状细胞性贫血基因的个体数量高于平均水平。杂合状态是最好的,因为它不使镰状细胞性贫血发展,同时也能预防疟疾。而纯合状态会产生患有镰状细胞性贫血或疟疾的个体。这就是为什么在疟疾流行地区,镰状细胞性贫血杂合子的数量高于平均水平,也是这种疾病不会消失的原因!携带状态实际上是受到自然选择的。 [1]
当 O2 结合到血红蛋白的一个活性位点时,会发生构象变化,这有助于血红蛋白协同作用。协同作用是指活性位点之间的相互作用,就血红蛋白而言,协同作用使氧气的结合随着一个位点的填充而增加,其余活性位点也更有可能与 O2 结合。

当 O2 结合到血红蛋白分子上的一个活性位点时,铁原子 Fe2+) 被氧化为 (Fe3+)。铁和氧气在血红蛋白中产生的相互作用是共振结构的组合,一种是 (Fe2+)和 O2,另一种是在 (Fe3+) 和超离子 O2 之间-。
O2 与铁中心的结合导致血红蛋白分子结构中组氨酸残基向卟啉移动的构象变化,最终导致血红蛋白的 O2 亲和力增加。含组氨酸基团的伴随运动会导致血红蛋白结构其余部分的构象变化。COO- 基团现在与 α-β 接口相互作用,导致相邻活性位点的构象变化。这些构象变化将导致血红蛋白的 O2 亲和力增加。
血红蛋白是一种变构蛋白。它与 O2 结合到其中一个亚基的能力受到其与其他亚基相互作用的影响。如上所述,O2 与一个血红蛋白亚基的结合会诱导构象变化,这些变化会传递到其他亚基,通过提高其对该分子的亲和力,使它们更易于与 O2 结合。H+、CO2 和 2,3-二磷酸甘油酸都是变构效应器,因为它们有利于脱氧血红蛋白的构象,因此促进 O2 的释放。由于这三种分子在不同的位点起作用,因此它们的影响是累加的。
-
酶的变构调节
X 射线晶体学表明,氧合血红蛋白(结合了四个 O2 分子的形式)在其四级结构上与脱氧血红蛋白(未结合 O2 的形式)有很大区别。在没有结合的 O2 时,Fe2+ 稍微偏离卟啉环的一侧,而卟啉环本身略微弯曲。当一个 O2 分子结合到血红素辅基时,它会将 Fe2+ 拉入卟啉环的平面,在这个过程中使环变平。Fe2+ 的运动导致近端组氨酸也移动。这反过来又改变了螺旋 F 的位置和螺旋两端的肽链区域。因此,亚基中心的运动传递到表面,在那里它导致将四个亚基结合在一起的离子相互作用断裂并在不同的位置重新形成,从而改变了四级结构,导致 O2 协同结合到 Hb 上。
氢离子和二氧化碳对氧气结合的调节称为波尔效应,该效应由克里斯蒂安·波尔于 1904 年提出。波尔效应描述了 pH 对血红蛋白氧气亲和力的影响,随着 pH 从 7.4 的值下降,血红蛋白对氧气的亲和力下降。当血红蛋白移动到 pH 较低的区域时,它释放氧气的趋势会增加,因此随着环境变得更酸性,会释放更多的氧气。

pH效应背后有化学基础。血红蛋白分子结构中的组氨酸残基是pH效应的一个因素。在高pH环境中,组氨酸的侧链不发生质子化,组氨酸末端羧酸盐基团与赖氨酸残基之间的盐桥不会形成。然而,随着pH下降,意味着在低pH水平下,组氨酸的侧链将发生质子化,从而与天冬氨酸形成盐桥。这种静电相互作用导致结构变化。盐桥的形成稳定了血红蛋白结构,导致血红蛋白对O2的亲和力降低,从而增加了氧气释放的趋势。
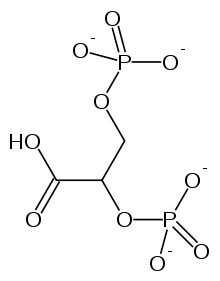
2,3-二磷酸甘油酸(2,3-BPG)对血红蛋白的影响被描述为别构效应。2,3-BPG是一种别构效应剂,它与氧气活性位点完全不同的位点结合。红细胞中2,3-BPG的含量对于决定血红蛋白的氧气亲和力至关重要。
单个2,3-BPG分子结合在脱氧血红蛋白结构的四聚体中心,位于T型结构的中心腔中。在T状态向R状态转变时,2,3-BPG被释放。因此,为了使T状态向R状态转变,血红蛋白与2,3-BPG之间的键需要断裂。在2,3-BPG存在的情况下,氧气与血红蛋白的结合更松散。构象变化允许结构稳定发生,从而使血红蛋白失去氧气亲和力。
二氧化碳能够通过两种机制刺激氧气释放
- 高浓度二氧化碳(CO2)的存在会降低血红蛋白的亲和力,因为红细胞的pH值下降。
CO2对血红蛋白有催化作用。CO2与水反应形成碳酸。然而,该反应需要二氧化碳被红细胞中的碳酸酐酶(一种酶)催化,最终生成H+和HCO3-。一旦碳酸解离成这两种离子,pH就会下降。pH的下降稳定了T状态,从而增加了氧气释放的趋势。
CO2 ↔ CO2 + H2O ↔ H2CO3 ↔ HCO3- + H+
- (CO2)与血红蛋白之间的直接化学相互作用会刺激O2的释放。(CO2)能够通过与末端氨基反应形成带负电荷的氨基甲酸盐基团来稳定脱氧血红蛋白。这种相互作用导致形成稳定T状态的盐桥,有利于O2的释放。
这也解释了二氧化碳从组织到肺的运输。组织细胞产生的CO2通过红细胞,形成如前所述的H+和HCO3-。它允许HCO3-与Cl-交换。因此,血液毛细血管中HCO3-的浓度升高,二氧化碳以这种形式被带到肺部。当HCO3-到达肺部时,逆反应发生,在肺部释放二氧化碳。
有几种分子会导致血红蛋白将氧气运输到组织的能力大幅降低。最常见的是一氧化碳(CO),它与血红蛋白的结合亲和力比氧气高200倍。一旦一氧化碳与血红蛋白结合,氧气亲和力就会增加,因为血红蛋白是一种四聚体,可以促进协同配体结合。然而,这会阻止氧气释放到需要氧气的组织中。CO和血红蛋白的复合物被称为碳氧血红蛋白。这被称为一氧化碳中毒,CO与氧气竞争性结合并阻止氧气运输。因此,即使是少量的一氧化碳也会对个体造成严重伤害。CO浓度低至0.02%就会引起头痛,而0.1%会导致昏迷。其他竞争性配体包括氰化物、硫化物、二氧化氮和硫化物。
胚胎和胎儿血红蛋白在亚基水平上与成人血红蛋白不同,其亚基界面强度不同。胚胎血红蛋白的亚基界面比胎儿血红蛋白的亚基界面弱得多,胎儿血红蛋白的亚基界面又比成人血红蛋白的亚基界面弱得多。在人类红细胞中,血红蛋白可以有八种不同的二聚体形成组合。每种形成都可以比其他形成更多,或者只在发育的不同时间存在。在胚胎发育中,有三种不同的类型:ζ_2 γ_2 (Hb Portland-1)、ζ_2 ε_2 (Hb Gower-1) 和 α_2 ε_2 (Hb Gowler-2)。胎儿血红蛋白由α_2 γ_2(HbF)组成,成人血红蛋白由α_2 β_2 (HbA) 以及微量的α_2 δ_2(HbA2)组成。虽然所有这些不同类型血红蛋白的三级结构几乎相同,但它们的初级结构在特定替换上有所不同,这些替换解释了它们不同的O_2亲和力以及它们与别构效应剂的相互作用。这些氨基酸替换会影响亚基的组装方式以及它们的相互作用方式。胚胎ζ_2 γ_2 (Hb Portland-1)、ζ_2 ε_2 (Hb Gower-1) 和 α_2 ε_2 (Hb Gowler-2) 在生命的最初几个月内被发现,以及第四种,ζ_2 β_2 (Hb Portland-2)。ζ_2 β_2 (Hb Portland-2) 是一种罕见的血红蛋白形式。每种血红蛋白中单体单元界面之间的强度差异很大,在脱氧状态下差异更大,在配体状态下变得更加强。四聚体[检查拼写]-二聚体解离常数根据它们所含的亚基而不同。例如,在两个相似的胚胎亚基ζ_2 ε_2 (Hb Gower-1) 和 α_2 ε_2 (Hb Gowler-2) 之间,从α到ζ亚基的解离常数有13倍的差异。因此,通过将不同类型的血红蛋白与具有一个相似亚基的血红蛋白进行比较,它们的解离常数可以提供广泛的信息。关于Hb Portland-2 的了解很少,因为它很罕见,只发生在一种α-地中海贫血(遗传缺陷)中。Hb Portland-2 与其他血红蛋白不同,因为它更容易从四聚体解离成二聚体,甚至更容易从二聚体解离成单体,而其他类型的人类血红蛋白会迅速从四聚体解离成二聚体,但不会从二聚体解离成单体。所讨论的解离发生在pH 7.5,但在pH降低后会发生显著变化。在HbA(成人血红蛋白)中,四聚体向二聚体的解离随着pH的降低而增加,每降低1个pH单位,解离就会增加10倍。当pH改变为6.3时,HbA中的解离主要为二聚体,而在Hb Portland-2中,解离主要为单体。由于这种情况,HbA中四聚体的形成比Hb Portland-2中四聚体的形成更有利,因为ζ_2 β_2 二聚体比α_2 β_2 二聚体弱得多。在HbA中,α和β亚基不稳定,但在Hb Portland-2中,ζ和β亚基作为二聚体界面较弱,但作为单体则稳定。胚胎血红蛋白在pH 6.3 下能够轻易解离,但Hb Portland-1 和 Gowler-1 比 Hb Gowler-2 解离更快。当混合胚胎血红蛋白 Hb Gowler-2 和 Portland-2 的单体并使其重新结合时,更强的四聚体形成是结果。而不是形成α_2 ε_2 (Hb Gowler-2) 和 ζ_2 β_2 (Hb Portland-2),而是形成了α_2 β_2 (HbA),以及ζ_2 ε_2,因为αβ界面最强,因此最有利。当将ζ_2 γ_2 (Hb Portland-1)、α_2 ε_2 (Hb Gower-2) 经过相同的处理时,胎儿血红蛋白α_2 γ_2(HbF) 的界面是结果,因为它远远强于胚胎血红蛋白。当混合ζ_2 γ_2 (Hb Portland-1)、α_2 ε_2 (Hb Gower-2) 和 ζ_2 β_2 (Hb Portland-2) 时,最有利的结果是HbA,而HbF 则无法检测到。所有三个实验都证明了亚基竞争有助于重排,并且由于更强的界面,α_2 β_2 的形成明显高于任何其他四聚体。Hb Portland-2 的罕见可能是由于四聚体-二聚体和二聚体-单体界面比任何其他人类血红蛋白都要弱。亚基竞争与为什么某些血红蛋白更容易形成有很大关系,因为具有更强界面的血红蛋白的形成优先于具有较弱界面的血红蛋白的形成。以及从较弱的形成中形成更强的形成。
血红蛋白是由负责表达血红蛋白的基因形成的。这些基因的缺陷会导致不规则的血红蛋白和贫血,这些情况被称为“血红蛋白疾病”。不规则血红蛋白出现在以下三种情况下。
1. 血红蛋白分子结构异常。两种血红蛋白亚基链(α链和β链)的基因变化被称为突变。通常,突变会改变亚基中的单个氨基酸组成部分。大多数情况下,这种变化是无害的,不会影响血红蛋白分子的结构或功能。然而,偶尔,单个氨基酸的改变会显著扰乱血红蛋白分子的行为,并导致疾病。镰状血红蛋白就是这种现象的代表。
2. 血红蛋白分子两种亚基中的一种产量减少。导致这种情况的突变被称为“地中海贫血”。正常功能需要等量的血红蛋白α链和β链。血红蛋白链的不平衡会破坏并摧毁红细胞,从而导致贫血。尽管受影响的血红蛋白亚基会死亡,但在大多数地中海贫血患者中,产生的少量亚基在结构上是正常的。
3. 正常亚基的异常关系。单个α链亚基和单个β-珠蛋白基因座亚基结合形成一个正常的血红蛋白二聚体。在严重的α-地中海贫血患者中,由于潜在的α链伴侣稀缺,β-珠蛋白亚基开始聚集成四聚体。这些β-珠蛋白亚基四聚体在功能上是失活的,不能携带氧气。在严重的β-地中海贫血患者中,不会形成类似的α-珠蛋白亚基四聚体。在没有β-珠蛋白基因簇伴侣的情况下,α亚基会被迅速破坏。
Berg,生物化学(第6版)和坎贝尔生物学(第5版)
Johnson RA, Lavesa M, Askari B, Abraham NG, Nasjletti A (1995年2月). "血红素加氧酶产物,可能是一氧化碳,在老鼠中介导一种血管舒张功能" http://sickle.bwh.harvard.edu/hemoglobinopathy.html
http://www.rockefeller.edu/labheads/chait/pdf/07/07_manning_prot-sci.pdf
- ↑ [血红蛋白和肌红蛋白],2012年11月14日。


