结构生物化学/蛋白质功能/肌球蛋白
肌球蛋白是一个大的运动蛋白超家族,它沿着肌动蛋白丝移动,同时水解 ATP 生成可用于各种功能的机械能,例如肌肉运动和收缩。大约 20 类肌球蛋白根据其 ATP 水解运动域中氨基酸序列的差异而被区分。不同类别的肌球蛋白在其尾部结构上也存在差异。尾部结构在不同的肌球蛋白类别中具有不同的功能,包括二聚化和其他蛋白质-蛋白质相互作用。
肌球蛋白是肌肉中的一种常见蛋白质,负责使肌肉收缩和放松。它是一个大型的非对称分子,有一个长尾和两个球状头部。如果解离,它将解离成六个多肽链。其中两个是重链,它们相互缠绕形成双螺旋结构,另外四个是轻链。肌球蛋白的一个主要特征是它能够与肌动蛋白非常特异性地结合。当肌球蛋白和肌动蛋白结合在一起时,就会使肌肉产生力量。
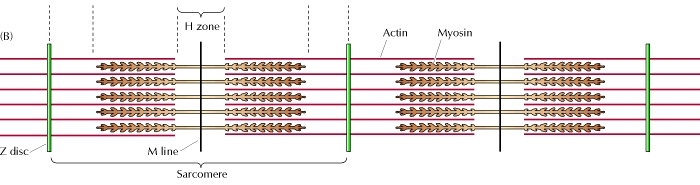
骨骼肌负责随意运动。骨骼肌包含许多肌纤维,这些肌纤维实际上是由肌原纤维组成的,肌原纤维是由粗肌球蛋白丝和细肌动蛋白丝组成的束状结构。肌原纤维以链状方式构建和排列,形成称为肌节的结构。肌节包含几个区域。一个区域称为 A 带,它只包含肌球蛋白丝。A 带的对应部分是 I 带,它只包含肌动蛋白丝。每个肌节的末端称为 Z 盘。每个肌节的中间区域称为 H 区,它只包含肌球蛋白。
根据安德鲁·赫胥黎和拉尔夫·尼德格克提出的滑行丝理论,肌肉收缩时,Z 盘彼此靠近,从而缩短肌节。I 带的肌动蛋白丝变得非常短,而 A 带的肌球蛋白丝的长度没有变化。肌动蛋白丝实际上是向 H 区和 A 带滑动,从而产生了肌球蛋白和肌动蛋白丝的重叠。当这种重叠发生时,肌球蛋白丝与肌动蛋白丝结合,使肌球蛋白能够作为丝滑动的驱动马达起作用。
这种肌球蛋白和肌动蛋白之间的相对运动是导致肌肉收缩的原因。肌肉收缩和作用的分子基础将在下一节中解释。
这种收缩机制也被称为“滑行丝理论”。
- ATP 与肌球蛋白头部结合会导致肌球蛋白处于低能构象。
- 活性位点关闭,ATP 水解为 ADP 和 Pi。这会诱导构象变化(头部弯曲),导致肌球蛋白与肌动蛋白弱结合。这形成了一个横桥。
- Pi 释放会导致构象变化,从而导致肌球蛋白更牢固地结合,并产生动力冲程。
- ADP 解离使肌球蛋白头部牢固地结合到肌动蛋白上。
- 新的 ATP 分子与肌球蛋白头部结合会触发它从肌动蛋白上释放,循环重新开始。
- 在没有 ATP 的情况下,这种状态会导致肌肉僵硬,称为尸僵。
肌球蛋白包含一组蛋白质,这些蛋白质将运动蛋白进行分类。运动蛋白涉及水解 ATP 的肌动蛋白丝。已经根据氨基酸序列区分了 20 种不同的肌球蛋白类型。所有 20 种肌球蛋白都具有不同的结构,其次是尾部结构。因为每个类别都具有二聚化和蛋白质相互作用的特征。然而,已知的肌球蛋白类别包括:肌球蛋白 I、肌球蛋白 II、肌球蛋白 V 和 VI。
肌球蛋白 I
在与耳聋相关的基因的蛋白质中,有几种类型的肌球蛋白。肌球蛋白 I 似乎将肌动蛋白丝交联起来,以控制每个立体纤毛内的张力。这种肌球蛋白马达沿着肌动蛋白丝的棘轮活动可能会调整毛细胞对不同声音的敏感度。其他类型的肌球蛋白利用其马达活性沿着肌动蛋白丝的长度重新分布细胞成分。
肌球蛋白 II
肌球蛋白 II 由六个多肽链组成:两个 220-kD 重链和两对不同的大小在 15 到 22kD 之间的轻链,具体取决于它们的来源。每个单个重链的 N 末端一半呈现球状形式,并向一个方向伸展。接下来是一个大约 100 埃长的 α 螺旋,由缠绕在其周围的两条轻链加固。当肌肉收缩时,蛋白质的这一部分充当杠杆。重链的 C 末端一半呈 α 螺旋形式,以长纤维链结束。其中两个结合并形成左手螺旋形卷曲螺旋基序。肌球蛋白的整体形状是长 1600 埃的杆状结构,有两个球状头部。
肌球蛋白 V
肌球蛋白 V 具有不同的马达结构。它具有一个两头运动蛋白,其中重链发散。这意味着肌动蛋白依赖性转运向轴突相关囊泡运动对黑色素产生影响。微管和肌动蛋白丝都导致了推测,并影响了毛发的颜色。肌球蛋白 V 也是一个双头蛋白,但它不像肌球蛋白 II 那样形成粗丝。肌球蛋白 V 单独起作用 - 尾部末端的结构域与带有色素作为货物的囊泡结合。该蛋白质的杠杆区域足够长,可以结合六条轻链,使其具有比肌球蛋白 II 的对应杠杆臂高三倍的轻链结合能力。在肌球蛋白 V 与 F-肌动蛋白丝结合的电子显微镜(EM)图像中,估计球状头部之间有 13 个肌动蛋白亚基。