结构生物化学/病毒通过内吞作用进入
尽管病毒在结构和组成成分方面并不复杂,相当简单,但它们与宿主细胞的相互作用却非常复杂。为了进入细胞,动物病毒利用了多种细胞过程,这些过程涉及许多细胞蛋白。尽管一些病毒能够通过质膜进入胞质溶胶,但大多数病毒依赖于内吞摄取,通过胞质溶胶的囊泡运输,以及运输到内体和其他细胞内细胞器。这种摄取病毒的过程与网格蛋白介导的内吞作用、巨胞饮作用、小窝/脂筏介导的内吞作用或其他机制有关。动物病毒利用许多方法和内吞机制来允许病毒进入细胞。

最初,病毒附着在细胞表面的蛋白质、碳水化合物和脂质上。病毒受体之间的相互作用通常是特异性的,至少具有 3 个价。此外,这些相互作用会导致细胞信号通路被激活。细胞通过利用几种内吞机制来整合病毒。在病毒进入内体或内质网腔之后,它们会获得信号,这些信号的形式是暴露于低 pH 值、蛋白水解裂解和病毒蛋白的启动。这些会导致病毒蛋白发生修饰,然后它们能够穿透液泡膜。在穿透液泡膜后,它们将病毒基因组、衣壳或保持在一起的病毒颗粒传递到胞质溶胶中。之后,大多数 RNA 病毒在胞质溶胶的各个位置复制。相反,大多数 DNA 病毒继续通过它们的通道前往细胞核。一个由分解和脱壳步骤组成的过程与病毒和病毒衣壳向细胞深处的移动平行进行。整个过程导致基因组和辅助蛋白以复制 компетентной 形式被有规律地分散。
出于多种原因,研究和了解病毒-宿主细胞相互作用非常重要。首先,由于世界人口增长、国际贸易和旅行的巨额增长以及全球变暖等许多因素,病原体和病毒可能造成的威胁和潜在损害正在呈指数级增长。因此,获取尽可能多的信息以帮助对抗目前存在的病毒或将来可能出现的病毒至关重要且有帮助。研究病毒与细胞之间的相互作用是一个不断发展的领域,其中包含许多未被发现的细节,这些细节可以帮助制定应对病毒的策略。
研究病毒与细胞之间相互作用的另一个重要原因是,病毒可以作为分子医学中的工具。病毒已经发展到可以进入细胞并带入外源基因和大分子。这就是为什么它们在基因治疗以及将大分子和药物运输到细胞中非常有用的原因。此外,病毒有可能识别出癌细胞并将其消灭。病毒是一个不断增长的重要工具,科学家可以利用和操纵它来开发分子、结构和细胞生物学领域的新策略和概念。
对噬菌体的形态学、遗传学和生化研究表明,感染机制极其复杂。他们还表明,T4 和 T2 噬菌体的形成类似于带有可收缩尾部的皮下注射器。这创造了一种机器,能够穿透革兰氏阴性细菌的两个膜并穿透胞质溶胶以送入 DNA。研究发现,附着在宿主细胞受体上具有作为信号的功能,该信号会激活注射过程。由于动物细胞的宿主细胞没有外膜和细胞壁,因此它们不需要复杂而精密的工具和机制来进入细胞。相反,细菌具有这些细胞壁和膜,这些细胞壁和膜抑制了到达质膜的途径。此外,动物细胞提供了内吞机制,这些机制会将进入的病毒送往宿主细胞的核周区域,在那里感染条件得到鼓励,并且到细胞核的距离最小。实际上,这使病毒能够自由地穿过与细胞质堆积和皮层中微丝的复杂结构有关的障碍物。通过内吞囊泡旅行的能力对于感染神经元的病毒尤其重要,在这些病毒中,细胞体分离的轴突具有非常长的距离。此外,具有缓慢变化条件的内体的成熟,例如 pH 值降低或氧化还原环境的转换,使病毒能够检测到它们在细胞内的位置以及通道。这还将允许内体利用这些信息来确定穿透和脱壳的时间。当存在某些蛋白酶(例如弗林蛋白酶和组织蛋白酶)时,它们会提供特定病毒所需的蛋白水解激活。此外,当动物病毒被内吞时,它们能够避免留下它们在质膜上暴露的证据。避免在质膜上留下暴露证据很重要,因为它会导致免疫监视的检测延迟。综合起来,内吞作用包含许多优势,导致病毒(如单纯疱疹病毒 1 和人类免疫缺陷病毒 1)利用内吞途径进行有效的进入,而不是直接进入。
病毒内吞作用的研究与内吞途径的综述相结合。了解这两个方面在这些广泛主题中的重要性。
动物病毒的大小范围从细小病毒的约 30 nm 到痘病毒的 40 nm 不等。大多数病毒的尺寸介于 60 到 150 nm 之间。尽管病毒通常呈球形,但也有一些病毒(例如丝状病毒、副粘病毒和流感病毒)可能是纤维状的,并且非常分散。当它们附着在细胞上时,病毒不会变形。另一方面,质膜通常会改变形状以适应病毒的形状。在某些情况下,内吞作用需要内陷。病毒的外层通常覆盖着附着在受体上的蛋白质,这些蛋白质以二十面体网格形式形成的衣壳蛋白或跨越整个病毒包膜的刺突糖蛋白形式存在。与受体的单独相互作用通常很弱,但与许多不同受体的相互作用会导致活性大幅提高,从而导致与细胞的结合几乎不可逆。多价结合会导致受体聚集,这可能导致与脂质域的结合和信号通路的激活。
当病毒颗粒到达内体时,病毒颗粒的尺寸通常与腔内囊泡相似。当它们太大而无法适应狭窄的管状延伸时,它们通常会定位于内体的球状、液泡区域,并且会被组织到降解途径中。
过去,病毒通常被用作内吞作用和膜转运研究中的模型货物。通过使用电子显微镜,可以很容易地识别出这些病毒,并且可以使用荧光基团或蛋白质对其进行识别,这使得能够在活细胞中进行单颗粒定位和监测。通过提供聚焦的光源,可以使用点扩散函数准确地勾勒出荧光病毒的质心。由于感染会导致放大,因此当病毒成功进入细胞时,即使病毒量很少,也可以很容易地测量到。此外,许多病毒学研究创造了许多工具,例如病毒突变体、荧光病毒、抗体、表达系统和修饰的宿主细胞。
脂筏的功能是控制膜上的信号转导、流动性和受体功能。这些通常富含胆固醇和鞘脂。使用小窝/筏依赖性途径的病毒形成主要内吞囊泡,这些囊泡依赖于胆固醇、脂筏和复杂的信号通路。这些途径使用酪氨酸激酶、磷酸酶和糖鞘脂。该过程由配体启动,这些病毒的穿透部位是内质网。使用这种途径最常被研究的病毒之一是多瘤病毒。这些病毒利用多个可用的受体以更好地结合。
尽管一些病毒利用具有明确内吞受体功能的受体,例如转铁蛋白和低密度脂蛋白受体,但大多数病毒附着的分子与细胞间识别、离子转运和附着在细胞外基质中具有不同的功能。大多数情况下,碳水化合物部分在病毒结合中起着重要的作用。
区分仅仅吸附病毒并帮助病毒集中在细胞顶端的吸附因子和作为触发因素,修饰病毒、促进细胞信号传递或激活穿透的病毒受体,这一点很重要也很有用。许多受体的共同目标是促进内吞作用,帮助病毒进入细胞。病毒进入时,通常先与吸附因子结合,然后与其他受体相互作用。实际上,很难区分吸附因子和受体,因为它们在感染的有效性中都发挥着作用。
最常见的吸附因子是蛋白聚糖中的糖胺聚糖链。与这些带负电荷的多糖的结合通常是静电的,并且不太特异。已经发现,在某些情况下,病毒在组织培养中适应时,会进化利用GAGs。另一种常见的碳水化合物类别是唾液酸,许多病毒会与其结合。类似于流感病毒和多瘤病毒的情况,大多数情况下,这种结合非常特异,并且涉及凝集素结构域或凝集素位点。
由于结合非常特异,这是决定嗜性(tropism)和物种特异性的重要原因,因此可以了解病毒性疾病的性质。受体特异性的另一个方面是,它可以识别病毒进入的内吞途径和细胞内转运的类型。例如,与转铁蛋白受体结合的细小病毒利用网格蛋白介导的摄取通路。它们还可以与其受体一起循环到细胞表面。相比之下,鼻病毒等不太常见的病毒组与LDL受体结合,在早期内体中与受体分离,并被送往晚期内体。
一些受体负责促进病毒的修饰,从而使病毒能够与辅助受体结合、促进内吞作用,或转变为膜融合活性构象。最明确的例子是HIV-1。因为在这种情况下,需要两种受体来促进构象改变,从而促进融合。腺病毒2和5含有两种受体,它们促进构象改变并促进内吞作用。对于禽白血病病毒,进入所需的信号是受体结合和低pH值。
病毒如何劫持细胞调控SLiMs 病毒的生命周期受其与细胞蛋白的相互作用的影响。它们可以接管和利用蛋白质来满足其自身机制的需要。然而,病毒是紧凑的空间受限,具有很小的基因组,但它们可以控制如此多的通路和过程。它们能够做到这一点的原因之一是,它们广泛地模仿宿主蛋白质的短线性基序(SLiMs)。
-
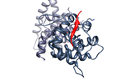
人乳头瘤病毒E7癌基因蛋白模仿与宿主视网膜母细胞瘤蛋白(深灰色)结合的LxCxE基序(红色)(PDB 1gux)。
当病毒进入细胞时,它们拥有自己的DNA和RNA聚合酶、解旋酶和蛋白酶,这些酶使复制、表达和成熟成为可能。但是,病毒仍然需要细胞的帮助来进行病毒复制。真核生物蛋白质组中存在被称为SLiMs的紧凑的非球状蛋白质相互作用界面。它们具有多种特异的功能,例如在短序列中编码功能性相互作用界面的能力、参与蛋白质的某个区域以及独立发挥功能和趋同进化的能力。它们的功能包括将蛋白质靶向特定目的地、充当蛋白水解切割的识别位点,以及提供特异性修饰、信号传导、识别、重新连接通路、分子开关等。
宿主通路的多样性被靶向,并影响它们的功能。其中一些包括宿主靶点14-3-3,由病毒蛋白Rep68与病毒AAV以及基序RsxSxP相互作用。另一个例子是宿主靶点ALIX,由病毒蛋白Gag与HIV以及基序LYPxxxL相互作用。因此,病毒利用这些基序的机制多种多样。
其中一种机制是细胞转运。将蛋白质定向到目的地需要大型复合物或微管的细胞骨架结构。因此,病毒蛋白通过复制这些基序来利用庞大的细胞基础设施。例如,信号模仿是HIV中必需的调节蛋白Rev的重要驱动力。
另一种机制是信号转导。SLiMs具有较低的结合亲和力和较快的脱落率,这促进了对不同刺激的快速反应。因此,病毒复制了信号基序并解除其通路的调控。
第三种机制是控制细胞蛋白水平。病毒蛋白充当支架,通过将底物特异性重新定向到非传统的宿主蛋白靶点。例如,在泛素连接酶募集过程中,病毒劫持细胞导致宿主多泛素化,随后被蛋白酶体降解。通过这样做,细胞蛋白发生改变,这使病毒蛋白能够存活并复制其基因组。破坏基序也可以用来抑制蛋白质的破坏,这可以延长原病毒蛋白的寿命。
第四种机制是转录调控,这是一个严格控制的细胞过程。即使如此,即使其调节也可以被基序模仿所破坏。
第五种机制是通过解除内源性修饰过程的调控来修饰宿主蛋白质组。病毒蛋白可以在宿主酶和病毒靶标之间充当支架。单个修饰最终可能导致整个基因组的修饰。
第六种机制是它们自己的修饰。病毒蛋白也可以通过模仿宿主酶的对接位点和修饰位点来指导自身的修饰。
病毒必须使用基序,因为细胞的正常功能在很大程度上受SLiMs的控制。它们是进化重新连接细胞调节通路的产物,这使得它们同样容易受到快速进化的病毒蛋白的影响,使病毒蛋白能够解除通路的调控。
SLiMs的长度,为3-10个残基,使其能够趋同进化。通常,一个或两个突变就足以创建一个新的基序。RNA病毒通常在每代中的每个位置经历10^-5 – 10^-3的突变,而DNA病毒通常经历10^-8 – 10^-5的突变。可以通过病毒株和分离株来检查这些病毒基序的趋同进化。病毒蛋白的表型变化是由于基序特异性的适应造成的。
病毒基因组的大小受到很大限制,但它们仍然与宿主细胞广泛相互作用。一旦病毒蛋白获得与蛋白质界面的相互作用,它就会改变预先折叠的区域,但宿主无法在彼此靠近的多个结合位点上运行,因此它们无法与许多这些不同的伴侣相互作用,因为它们在空间上受到限制。病毒蛋白质组通常具有折叠结构。通常,病毒接管一个过程并不需要球状界面,但尽管如此,仍然有多种对比机制可用来操纵特定的通路或蛋白质。
真核生物调节系统很强大,因为细胞网络协作。病毒也可以利用这些机制变得强大。基序的小尺寸也使病毒蛋白能够抵抗突变和适应。SLiMs的模仿也很强大。
Mercer, Jason, Mario Schelhaas, and Ari Helenius. "Virus Entry by Endocytosis." Annual Review of Biochemistry 79.1 (2010): 803-33.