高级无机化学/电子吸收光谱基础
紫外-可见光谱是一种分析化学技术,用于确定各种化合物的存在,例如过渡金属/过渡金属离子、高度共轭的有机分子等等。然而,由于本课程的性质,这里只讨论过渡金属配合物。紫外-可见光谱通过使用光将金属的 d 电子从基态构型激发到激发态来工作。简而言之,当以光形式的能量照射过渡金属配合物时,d 电子将获得能量,紫外-可见分光光度计测量特定波长光下具有激发电子的过渡金属原子的丰度,从可见光区域到紫外区域。
在使用紫外-可见分光光度计时,待分析的溶液通过将样品放入比色皿中,然后将比色皿放入分光光度计中来制备。然后,机器发出来自可见光和紫外光波长的光波,并测量样品吸收了多少每种波长的光,然后发射。
样品的吸光度可以通过比尔-朗伯定律计算:A=εlc,其中 A 是吸光度,ε 是样品摩尔吸光系数,l 是所用比色皿的长度,c 是样品的浓度。[1]当分光光度计产生吸收图谱时,摩尔吸光系数就可以计算出来。

为了说明这看起来像什么,你将在右侧找到一个示例吸光度谱。[2] 404-5</ref> </ref> 如图所示,y 轴表示吸光度,x 轴表示正在扫描的光的波长。这种特定的过渡金属配合物 [CrCl(NH3)5]2+ 在紫外光区域(大约 250-275 纳米)的吸光度最高,并在分别接近 400 纳米和 575 纳米的两个地方有轻微的吸光度峰。这两个峰远不如前一个峰明显,因为电子的跃迁是部分禁戒的——这将在本章后面讨论。如果跃迁被禁戒,则不会有太多过渡金属电子会经历激发。

众所周知,d 轨道包含五种类型的亚轨道:dxy、dyz、dxz、dx2-y2 和 dz2,这些亚轨道都在右侧显示出来[3]。当不存在磁场时——例如,当不存在电子时——所有亚轨道组合在一起形成一个简并的球形轨道。当引入电子或过渡金属与一组配体键合时,这个单个轨道会立即重新区分成其亚轨道。 
这种区分导致了金属配合物中颜色的起源。
当观察过渡金属配合物中的颜色时,有必要关注区分后的 d 轨道。这种意义上的颜色源于从一个能级到下一个能级的 d 轨道电子的激发。例如,t2g 成键轨道中的电子可以被光激发到 eg* 成键轨道,并且当它下降回基态时,能量以光的形式释放:

激发电子到 eg* 轨道所需的特定波长直接与电子回到基态时发出的颜色相关联。右边的图有助于可视化过渡金属颜色的特性。吸收了哪种颜色,就会发射互补色(与图中颜色完全相反)。例如,如果金属配合物发射绿光,我们可以推断出该配合物吸收了波长在 630 纳米到 750 纳米之间的红光。
发射颜色的强度基于两个规则:[4]
- 自旋多重度:当电子被激发时,配合物的自旋多重度不能改变。多重度可以通过公式 2S+1 计算,其中 S 由 (1/2)(未成对 d 电子的数量) 计算得出。
- 如果分子中存在对称中心(即反演中心),则不允许 g 到 g 或 u 到 u 的电子激发。
如果配合物违反了其中一条规则,我们说它是一个禁戒跃迁。如果违反了一条规则,它就是单禁戒的。如果违反了两条规则,我们就称它为双禁戒,等等。虽然约定俗成地称之为禁戒,但这并不意味着它不会发生;相反,配合物违反的规则越多,它的颜色就越淡,因为跃迁发生的可能性越小。让我们再看看前面的例子:
如果我们将强度规则应用于它
- 跃迁前的多重度=2(0.5[1 个未成对电子])+1=3,跃迁后的多重度=2(0.5[1 个未成对电子])+1=3。两种多重度都相同,因此这种跃迁在规则 1 下是允许的。
- 如果我们假设这个分子是八面体对称的,这意味着它有一个反演中心,因此 eg* 到 t2g 的跃迁在规则 2 下是被禁戒的,因为这两个轨道都是 gerade (g)。
- 我们只激发了一个电子,因此它在规则 3 下是允许的。
根据这些规则,我们可以看到这种跃迁只是单禁阻的,因此它只会显得稍微褪色和浅色,而不是深而丰富的绿色。
事实证明,与过渡金属键合的原子会影响络合物吸收的波长,从而发出光;我们将此称为配位场理论。虽然某些过渡金属喜欢吸收不同于其他过渡金属的波长,但配体在确定电子激发所需的波长方面起着最重要的作用。[5]
低自旋和高自旋这两个术语用来描述 t2g 和 eg* 轨道的能级差异,这与从 t2g 到 eg* 激发电子的所需光波长相关。当一个络合物被描述为低自旋时,与金属结合的配体会提高 eg* 轨道的能量,以至于络合物基态构型在 eg* 轨道被填充之前先填充 t2g 轨道中的前六个电子。因此,需要高能波长的光——紫光、蓝光和绿光——才能成功地将电子激发到 eg* 成键轨道。这意味着过渡金属络合物将分别发出黄光、橙光和红光。相反,高自旋络合物的配体会降低 eg* 轨道的能级,因此低能光——红光、橙光和黄光——甚至高能光也能成功地激发电子。因此,高自旋络合物可以发出任何颜色。在激发电子所需的波长方面,高自旋络合物可以被认为是全包容的,而低自旋络合物则是半排外的。
要确定一个络合物是高自旋还是低自旋
- 观察过渡金属。第一排金属会倾向于高自旋,除非配体迫使它成为低自旋。第二排金属会倾向于低自旋,除非配体迫使它成为高自旋。第三排金属会是低自旋。
- 观察配体,因为它们是最终的决定因素。如果配体在高自旋/低自旋方面与过渡金属相匹配,那么络合物的自旋将是它们“一致”的。如果它们不同,则遵循配体的自旋类型。如果配体既不是高自旋也不是低自旋,则遵循过渡金属的自旋类型。配体自旋类型在下文列出。
- 如果有多种配体具有不同的自旋类型,则选择络合物中最丰富的自旋类型。
以下配体从低自旋(t2g 和 eg* 之间最大的能级差)到高自旋(最小的能级差)排序:[6] 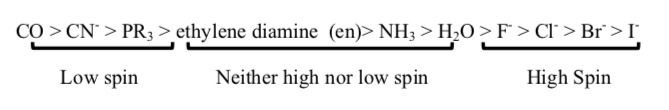
为了说明这个概念,让我们看看以下络合物
[Ni(NH3)6]2+, [Ni(CN)4]2-
所有镍络合物在金属上的氧化态都相同(2+),因此 d 电子数量相同。在第一个络合物中,镍倾向于高自旋,而氨既不倾向于高自旋也不倾向于低自旋。因此,络合物将是高自旋并发出蓝光,这是对橙色——弱能量——光的吸收。对于第二个络合物,镍再次倾向于高自旋,但氰化物倾向于低自旋。因此,络合物成为低自旋,并将发出黄光,这是对紫色——强能量——光的吸收。
- ↑ 无机化学,Miessler、Fischer 和 Tarr,2013 年,第 404 和 405 页
- ↑ 化学 LibreTexts,电子光谱:解释,https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Spectroscopy/Electronic_Spectroscopy/Electronic_Spectroscopy%3A_Interpretation
- ↑ 无机化学原理,Brian William Pfennig,2015 年,第 88 页
- ↑ 无机化学,Miessler、Fischer 和 Tarr,2013 年,第 414 页
- ↑ 无机化学原理,Brian William Pfennig,2015 年,第 526 页
- ↑ 无机化学原理,Brian William Pfennig,2015 年,第 523 页
