数字放射成像的基本物理原理/应用

本章介绍了数字放射成像的一些临床应用。普通放射成像作为诊断放射成像的主要手段之一,已经从传统的基于胶片的成像过程转变为基于数字技术的成像过程。本章将讨论这些变化对辐射剂量和图像质量的影响。还将讨论一些专业应用,例如乳腺X线摄影、数字减影血管造影、C型臂CT、多探测器CT、双能放射成像和图像融合。
自世纪之交以来,数字图像接收器在普通放射成像中得到越来越广泛的应用。早期研究表明,在骨骼放射成像中,数字图像接收器的图像质量优于胶片/增感屏技术[1][2]。在此基础上,曝光技术的改进也随之而来[3][4][5][6]。此外,还对传统放射成像与各种形式的计算放射成像 (CR) 与直接和间接数字放射成像 (DR) 的剂量进行了比较[7][8][9]。此外,还研究了数字图像接收器在透视应用中的性能[10]。
这些研究结果表明,数字技术具有显著优势。总的来说,图像接收器的变化在技术上类似于摄影中从基于胶片的相机向数码相机的转变。然而,在实施数字放射成像时,工作实践的变化和资本成本是主要考虑因素[11]。
截至2010年的经验表明,从物理学的角度来看[12][13]
- 标准CR板相对于传统的400速胶片/增感屏系统没有剂量降低,
- 双面读取CR的DQE比单面读取CR高约40-50%,
- 结构化磷光体CR的DQE比双面读取CR高约50%,接近间接DR的DQE,
- 具有结构化磷光体的间接DR接收器在低于4 LP/mm的空间频率下,DQE约为直接DR接收器的两倍,
- 间接、结构化磷光体DR的剂量比400速胶片/增感屏系统低30-50%,以及
- 对于身体高度衰减的区域(例如胸部X线照片的心脏后方区域和隔膜下方区域),剂量节省有限,但在X射线透明度高的区域(例如肺部区域)可以超过50%。
从实际角度来看,图像接收器与数字图像处理器之间整合了Wi-Fi连接性,从而提高了这些设备在临床应用中的便利性。还开发了CR成像盒(包括读取设备)和尺寸与传统胶片/增感屏盒类似的DR盒。因此,它们可以在患者床、立式增感屏架和其他放射成像设备的设计上无需进行重大改变的情况下使用。
DR技术的应用也推动了新的成像技术的发展,如数字体层摄影和时间减影,以及新的数字图像处理形式,例如胸部X线照片中的肋骨抑制[14]和计算机辅助诊断 (CAD)[15]。然而,这些主题超出了我们这里讨论的范围。
乳腺X线摄影是一种软组织成像形式,所使用的仪器专门设计用于对女性乳房进行成像。因此,需要低能量的X射线来利用光电效应,从而增强不同类型组织之间的区分。此外,成像系统还需要分辨微小细节,例如微钙化。因此,需要使用小焦斑X射线管和高分辨率图像接收器。这些具体要求将在下面更详细地讨论。

- 钼 (Mo) 可以用作X 射线管 (XRT) 中的阳极材料,而不是钨。钼能量谱由 17 到 19 keV 之间的 K 特征线和轫致辐射连续谱组成 - 见图 7.22。轫致辐射可以通过添加钼滤波器来衰减,钼滤波器优先消除低能辐射,否则低能辐射将被组织完全吸收,对图像形成几乎没有贡献,以及高能 X 射线,否则会降低物体对比度。这是一个K 边缘过滤应用的例子。
- 铑 (Rh) 也可用于阳极和滤波器材料。Rh 的 K 边缘为 23.2 keV,略高于 Mo,这对于以比 Mo 阳极更低的吸收剂量对更厚、更密集的乳房进行成像可能具有优势。这是由于 Rh K 层特征 X 射线的穿透能力更强。其他阳极/滤波器组合,例如 Mo/Rh、W/Ag 和 W/Rh 也已被使用。
- 大多数用于接触乳腺造影的 X 射线管具有小的焦点(例如 0.3 mm),小于一般放射学中使用的一半。需要这种小的焦点来对细微细节进行成像,例如微钙化,其大小可能不超过 100 μm。XRT 阳极的热量会限制管电流,最大不超过约 100 mA,在 25 kV 下,因此需要长达 3 秒或更长时间的曝光时间来进行补偿。因此,在曝光期间需要抑制患者的运动。
- 乳腺造影 XRT 通常采用金属外壳(而不是通常的玻璃),并有一个薄的铍 (Be) 出射口。这种设计具有抑制焦外辐射的优点。此外,可以构造 X 射线管,使阳极-阴极轴偏移以实现小的焦点尺寸 - 见图 7.23。
- 此外,已经发现焦点应该位于一条垂直于图像接收器的直线上,这条直线包含胸壁边缘。同样重要的是,准直器也应进行调整,以确保 X 射线束在该边缘上与图像接收器相交。

乳腺造影图像接收器
[edit | edit source]- 理想的乳腺造影成像系统将需要极限空间分辨率约为 20 LP/mm 或更高,动态范围至少为 5,000:1,并且对患者的辐射剂量最小。一个典型的 18x24 cm 的视野需要至少 9,600x7,200 像素的矩阵尺寸,每个像素至少有 12 位深度,才能实现所需的空间分辨率。因此,一张图像所需的计算机存储量为 132 兆字节。即使在 10 LP/mm 的极限分辨率下,单个数字图像也仍然需要 33 兆字节的存储空间。
- 将 CR 技术应用于乳腺造影的主要问题是其空间分辨率,其限制在约 5 LP/mm 以下,一般使用的采样率为 10 像素/mm。然而,由于后采集数字图像处理可获得更高的对比度和动态范围,因此预期的分辨率损失可能不是一个严重的问题。减小刺激激光束的直径、使用更薄的荧光粉层和双面读出 CR 板[17]是三种可以用来解决这个问题的方法。
- 直接和间接 DR 接收器都可以用于数字乳腺造影。在这里,制造技术将像素尺寸限制在大约 70-100 μm,图像尺寸高达 3,328x4,096 像素,面积高达 24x29 cm。再次假设,空间分辨率的缺乏通过图像接收器的宽动态范围以及数字图像处理的空间频率和对比度增强能力得到补偿。
- 另一种获得数字图像的技术涉及将传统的荧光粉屏通过透镜或光纤耦合到电荷耦合器件 (CCD)。在小视野应用中,CCD 矩阵可能只有 1,024x1,024 像素,系统已经证明了约 10 LP/mm 的极限空间分辨率。可以使用 CCD 阵列来实现更大的视野 - 见图 7.24,面板 (a)。当单个像素的大小为 40 μm 且探测器区域为 18x24 cm 时,将产生 4,800x6,400 像素的图像矩阵,这可以提供 12.5 LP/mm 的空间分辨率。更广阔的区域接收器也已在通用放射学中得到应用,并且已经对多光束均衡放射照相(AMBER)的数字实现进行了研究[18]。
- 另一种选择是使用狭缝扫描装置 - 见图 7.24,面板 (b)。在这里,穿过压缩乳房的透射 X 射线在 CsI:Tl 荧光粉条带中产生光,该光被光纤收集并传送到 CCD 阵列。这种设计的某些特点是
- X 射线束准直成狭窄宽度(例如 22 x 1 cm)的扇形,具有高水平的散射抑制,
- 荧光粉耦合到多个离散的 CCD 阵列,这些阵列并排放置在一起形成线性阵列。每个 CCD 阵列具有 2,048x400 像素,尺寸足够小,以使系统能够实现 10 LP/mm 或更高的空间分辨率,
- 通过以恒定速度扫描扇形 X 射线束穿过乳房,逐行获取图像 - 见图 7.25。这种图像获取形式类似于计算机断层扫描 (CT) 扫描中使用的扫描投影放射照相图像,也称为探测视图,
- 图像获取时间为 5 秒,以及
- 由于 X 射线视野和荧光粉探测器相对较小,散射并不构成严重问题,因此不需要使用栅格 - 这意味着患者的潜在剂量节省。

- 扫描狭缝方法的缺点之一是需要较长的曝光时间,这会增加 X 射线管的负荷。可以使用钨阳极 XRT 来解决这个问题,与钼阳极 X 射线管相比,钨阳极 XRT 的 X 射线产生效率和散热效率明显更高。X 射线管可以在 20 到 45 kV 之间运行,可以选择 Al、Mo 或 Rh 滤波器。鉴于先前关于使用低 kV 以获得高物体对比度的讨论,这似乎是适得其反的。但是,探测器的动态范围为 5,000:1,因此,虽然物体对比度降低了,但仍然可以获得高图像对比度。
- 还开发了基于光子计数探测器的扫描系统,例如晶体硅 X 射线探测器和多通道气体电离室。它们具有这样的优点:它们检测到探测器中发生的每个 X 射线光子吸收事件,而不是像传统图像接收器那样对多个光子产生的图像信号进行积分。因此,可以使用阈值技术来抑制图像噪声。
- Lazzari 等人 (2007)[19]比较了五种用于数字乳腺造影的成像系统的性能。发现直接 DR 图像接收器的 DQE 比间接 DR 图像接收器高,并且两者都优于扫描狭缝系统。此外,数字断层合成技术的乳腺造影应用[20],称为数字乳腺断层合成 (DBT),已被研究[21]。
- Sprawls (2019)[22]回顾了乳腺造影的历史发展。
乳腺造影 AEC
[edit | edit source]- 与传统射线照相中的AEC不同,控制探测器不能放置在CR成像盒前面,因为它会过度衰减X射线束并投射自身的X射线阴影。阴影在乳腺X线照相中使用的低X射线能量下尤为明显。但是,当将其放置在盒后时,到达控制探测器的X射线通量量受图像接收器中吸收的影响很大,而图像接收器本身又强烈依赖于从患者体内射出的X射线光子的能量。最终结果是,传统的AEC装置对乳房类型、厚度和千伏的变化补偿非常差。然而,这些问题可以通过微处理器控制的HV发生器开关来克服。AEC探测器测量瞬时剂量率,并根据所选kV和/或测量的乳房厚度,使用查找表(LUT)在适当的时间终止曝光。每个操作模式可以设置一个单独的LUT,例如,带网格的接触乳腺X线照相、不带网格的接触和放大成像。
- AEC的功能可以使用自动kV操作模式进行扩展。控制系统在曝光启动后约10-30毫秒内快速确定,所选kV是否能够在足够短的时间内实现所需的图像质量。如果不是,可以适当地提高kV,以确保曝光时间限制(由管负载决定)不会超过。
- 直接射线照相(DR)系统可以使用图像接收器本身作为AEC传感器[23]。
乳腺X线照相散射减少
[edit | edit source]- 乳房组织的压缩对于
- 压缩垫可以用薄的聚碳酸酯或压克力板制成。它们的设计使得当乳房被压缩时,可以防止乳房组织向上爬到胸壁。
- 此外,网格用于进一步减少散射辐射并提高主体对比度。它们通常是移动的网格,由碳纤维间隙制成,尽管其他设计也正在使用,例如,蜂窝网格,使用铜作为衰减器,空气作为间隙材料。布基系数通常为2-2.5,网格比率为4:1或5:1。
- 对于小于28kV的千伏,通常可以实现足够的主题对比度,对于更薄的乳房厚度,甚至更低(例如23kV)。
放大乳腺X线照相
[edit | edit source]
- 放大乳腺X线照相,m=1.5-2.0,广泛用于需要病灶定位技术的随访研究。放大射线照相有几个技术优势,包括
- 提高记录系统的空间分辨率,
- 减少由图像接收器结构成分引起的图像噪声,以及
- 减少散射,因为气隙(例如15-30厘米),特别是在锥形放大研究中。
- 请注意,这些优势是以增加乳房在初级束中的部分的辐射剂量为代价的,因为许多临床系统需要将乳房定位到更靠近X射线管的位置 - 例如,参见图7.26。
- 此外,放大乳腺X线照相通常使用小至0.1毫米的焦点。在最大管电流仅为15-25mA的情况下,曝光时间过长的问题很严重。可以通过将千伏提高到30-32kV来达到患者运动和主题对比度之间的折衷方案,从而将曝光时间保持在合理的范围内。然而,应该意识到放大成像是一种剂量较高的技术,这是由于乳房与焦点的接近,因此导致皮肤剂量增加高达四倍。虽然这种增加部分被乳房的区域一般只被照射且这种视图不需要网格这一事实抵消了,但最终结果是吸收剂量增加了大约两倍。
立体定向成像可用于协助核心活检采样,例如,使用14-号针。虽然可以对传统的乳腺X线照相设备进行附件,但俯卧式系统提供了更好的人体工程学,该系统将要活检的乳房通过患者床上的一个孔放置在悬垂位置。XRT、压缩垫、图像接收器和活检枪都安装在桌子下方,桌子的高度可以调节,以便为放置针头留出足够的空间。活检枪通常安装在游标驱动的桌子上,这使得在活检过程中可以精确地定位针头。压缩乳房中含有可疑病灶的局部区域的图像通常使用XRT在两个不同位置拍摄,通常与成像平面垂直的线成±15°,以便为计算机控制的活检针前进提供坐标信息。
最后,应该注意的是,在年龄在40至55岁之间的一组10万名女性中,每年进行乳腺癌筛查,直到74岁进行两年一次的筛查,剂量为每次乳房检查3.7mGy[24]。据预测,这些暴露最终会导致86例乳腺癌,其中11例为致命性乳腺癌,并且由于早期发现,将节省10,670个女性年。因此,与40岁以上女性常规乳腺X线照相筛查相关的辐射诱发乳腺癌风险被认为非常低,特别是与筛查的预期益处相比,因此,辐射风险不应该阻止女性进行乳腺X线照相筛查。
数字减影血管造影
[edit | edit source]数字减影血管造影(DSA),顾名思义,涉及图像减影技术 - 参见图7.1。正如将在下面看到的那样,该技术不仅仅是在数字图像处理器中应用减影过程。此外,将看到,所使用的技术类型虽然基于透视系统的设计,但需要包含DSA特有的许多修改。然而,在讨论技术之前,需要介绍一些基本的物理学知识,这些知识将有助于将随后的技术讨论置于背景中。

基本DSA物理学
[edit | edit source]- 减影血管造影过程,如图7.2所示,涉及从同一区域的造影前图像(通常称为掩模图像)中减去造影后图像(通常称为实时图像)。当假设单能X射线照射患者并且没有产生散射辐射时,实时图像的适当点的辐射强度I2与掩模图像的相同点的强度I1的关系为

- 其中μc、ρc和tc分别是对比介质的质量衰减系数、浓度和厚度。因此,当I2直接从I1中减去时,减影图像由下式给出
- 因此,
- 因此,
- 这个方程式表明,减法信号 D 包含来自掩模图像 I1 的信息,以及来自实时图像的信息。因此,减法图像中不透明血管的密度将包含依赖于患者血管下方和重叠的解剖结构细节的伪影。这些伪影是由于物质中辐射衰减的指数性质造成的。理想情况下,可以通过在减法之前计算透射强度的自然对数来减少这些伪影。这样做时,减法图像现在仅取决于对比剂,而不受周围解剖结构的伪影影响,如下所示
- 所以
- 因此,
- 许多 DSA 系统利用上述推理在减法之前对掩模和实时图像进行对数变换。此对数减法过程的第二个理论优势是生成不受成像设备空间不均匀性影响的图像。例如,X 射线图像增强器 显示出明显的空间不均匀性。
- 对数减法的第三个理论优势是生成图像,其中图像密度与对比介质的投影厚度 ρctc 成正比。此特性导致对图像进行密度分析,以推导出临床上有用的功能指标,例如百分比狭窄和左心室射血分数。但是,重要的是要注意,上述推理基于许多简化的假设(例如,单能辐射,无散射),当将其包含在上述处理中时,会使所得出的总体结论无效 - 请参见图 7.3。然而,对数减法在临床 DSA 中得到了广泛应用。
- 请注意,直接对数变换后会导致灰度级的大量压缩,并且通常使用将变换后的像素值乘以比例因子来重新建立灰度级。术语数字减影血管造影现在可以理解为一种简化,因为要理想地实施该技术需要对数变换和乘法,以及像素值的减法。

- 图 7.3 说明了 Dlog 对对比介质的投影厚度 的依赖关系,适用于一系列散射与初级比率 (SPR),即检测到的散射辐射和初级辐射强度的比率。这些图是通过在上述分析中包含散射贡献生成的。从图中可以看出,随着 SPR 的增加,Dlog 显着降低,并且对投影厚度的依赖关系变得非线性。例如,可以看出,当 SPR=5 时,在 50 mg cm-2 的投影厚度下,Dlog 降低了约 85%,相对于无散射条件而言,即不透明血管的对比度将降低这个因子。此外,可以看出,当 SPR=5 时,例如在约 20 mg cm-2 以上,Dlog 变得相对独立于投影厚度,因此,区分不同投影厚度的能力(以及由此产生的血管不透明度)会显着下降。
- 与本次讨论相关的另一个问题涉及临床成像条件下典型的 SPR。下表显示了胸部 X 射线照片 的测量 SPR,以说明情况。例如,可以看出,当不使用栅格时,所有解剖区域的 SPR 都大于 1,即散射强度始终超过初级强度。还可以看出,使用 12:1 栅格可以实现最大的 SPR 降低。现在参考图 7.3,可以看出,散射减少技术(例如,使用空气间隙或栅格)因此可能会改善不透明血管的对比度,并且它们的对比度仍然会比无散射条件下显着降低。
| 成像技术 | 肺 | 肋骨 | 心脏 | 纵隔 |
|---|---|---|---|---|
| 无栅格 | 1.22 |
1.78 |
4.26 |
10.1
|
| 30 厘米空气间隙 | 0.54 |
0.61 |
1.78 |
4.56
|
| 6:1 栅格 | 0.59 |
0.75 |
1.7 |
3.55
|
| 12:1 栅格 | 0.35 |
0.47 |
0.85 |
1.33
|
- 很明显,本次讨论与前面章节中关于组织中骨骼成像的 SPR 考虑因素一致。
- 可以使用计算机图像处理来实现改进的散射减少。这些方法包括基于对散射场的估计以从患者图像中减去散射场的那些方法,以及基于图像反卷积技术的那些方法。散射减法技术使用散射和初级测量来计算一个平滑的、缓慢变化的散射场,通常很麻烦,并且需要至少两次解剖结构的曝光。此外,由于数字化的离散性质以及信号与噪声比 (SNR) 的降低(因为减法过程会降低信号并保持噪声),减法图像的动态范围降低。
- 图像反卷积技术基于空间滤波过程,其中假设散射场具有低空间频率内容,并且在散射校正过程中抑制了这些频率。然而,这种方法缺乏对特定散射场中实际空间频率的准确了解。
DSA 图像噪声
[edit | edit source]- 图像减法过程对图像中噪声 的存在高度敏感 - 理论上,噪声会增加约 40%,这是减法过程的直接结果,这是由于噪声方差 的二次加法造成的。因此,需要在 DSA 成像中应用降噪技术以提高血管造影细节的显着性。DSA 图像中的主要噪声来源是量子噪声 - 这是由 X 射线产生的随机性造成的,以及系统噪声 - 这是由成像系统的电子元件造成的。例如,XII 基荧光镜中系统噪声的主要来源通常归因于摄像机。
- 这些来源的组合贡献会导致图像中区域出现斑点外观。反映这种斑点的 DSA 图像质量指标是图像中不透明区域的信噪比 (SNR)。自然,当使用高辐射照射量和高质量成像组件时,SNR 会很高。但是,它也取决于个人检查中被调查区域的不透明度以及对比剂的数量。
- 当量子噪声是主要噪声源时,可以证明 SNR 与对比剂浓度 ρc 和 XII 入口处吸收剂量 DXII 的平方根成正比,即
- 这种关系表明,为了使 SNR 翻倍,血液中的对比剂浓度可以翻倍,或者曝光量可以增加四倍。很明显,这两种方法都会增加患者因该程序而遭受的风险。
- 其他可以证明对 SNR 有益影响的因素包括
- 通过放置例如增量材料在高透射率区域上来均衡整个图像的透射率,以生成图像所有区域的近似相似的透射率。
- 选择略高于碘 K 边缘(即高于 33 keV)的 X 射线能量。因此,当使用较低的千伏电压时(例如 65 kV 而不是 100 kV),可能会获得具有更高 SNR 的图像,直到 K 边缘和 X 射线管 (XRT) 的输出所施加的限制。
- 重要的是要注意,上述考虑假设量子噪声在成像系统内部来源的噪声中占主导地位。此条件只能通过使用高质量成像组件来直接满足。还应注意,当系统噪声超过量子噪声时(例如,在具有噪声或有缺陷摄像机的透视系统中),增加辐射照射量不太可能降低图像中的噪声。
- 图像噪声也可以通过DSA图像处理器来降低。这是通过对计算机采集后、减影前的一系列血管造影图像进行图像平均化处理来实现的。最简单的图像平均化形式包括将多个图像加在一起并除以该数字。可以根据统计学原理证明,此过程理想情况下可以将噪声降低 √N 倍,其中 N 是平均图像的数量。因此,要使信噪比提高一倍,应平均四个图像。信噪比的改善也可以通过整合(即添加)图像和递归滤波来实现。后一种过程可能涉及对血管造影图像序列应用指数加权移动平均过程。可以证明,这种滤波比简单平均更强大,可以提供理论上的信噪比改善 √(2N-1)。请注意,这种类型的滤波也可以应用于筛查曝光,提供有时被称为荧光噪声降低 (FNR) 的功能。数字噪声降低技术通常使用DSA图像处理器的图像ALU组件来执行。

- 数字噪声降低的时间平均化功能也可以用于图像呈现目的,以便可以使用单个图像(见上面所示的外周研究中图7.4中的示例)来显示造影剂在研究过程中的运动时间过程,而不是使用一系列多个图像。这样的图像有时被称为血管轨迹。
- 传统的DSA成像可以被认为是广义图像处理的子集,称为时间滤波。这种通用方法侧重于对图像进行时间处理,以消除例如对所有获取图像都通用的特征,并增强在图像序列时间过程中发生变化的特征。此外,该概念表明,图像减影只是众多可实现预期结果的机制之一。例如,传统DSA的一个缺点是,大量患者剂量没有用于生成诊断图像。在极端情况下,考虑一个涉及获取25张图像的DSA图像序列,并假设其中只有两张图像用于生成显示感兴趣血管的图像。在这种情况下,只有8%(即2/25)的剂量得到利用,而其余92%的剂量基本上被浪费了。时间滤波图像序列试图通过将25张图像中的更多图像用于生成诊断图像的数字处理来克服这一限制。
- 一种时间滤波方法,称为集成掩模模式DSA,涉及将造影剂到达之前获取的多张图像加在一起(也称为整合)以形成集成掩模图像,并将多张峰值混浊图像加在一起以形成集成实时图像。这是用于生成图 7.4 中血管轨迹图像的过程。因此,当使用四张图像生成每个集成掩模和实时图像时,25张图像中的八张现在用于减影过程,因此只有68%的剂量被浪费了,并且减影图像具有更低的噪声。
- 第二种时间滤波方法,称为匹配滤波,试图利用所有 25 张图像。它涉及使用从感兴趣血管中造影剂浓度的时间变化中获得的信息。此信息可以通过使用密度分析软件绘制血管区域的稀释曲线来获得,即造影剂时间过程的图。然后使用此稀释曲线来定义应用于序列中每个图像的一系列权重因子,并将得到的图像简单地加在一起。由于整合了图像,处理后的DSA图像具有相对较高的信噪比。此类滤波器的进一步改进可用于将到达时间和峰值混浊时间等参数颜色编码到显示的图像数据中。尽管匹配滤波在理论上和实验上已被证明可以生成具有良好图像质量和剂量利用特性的DSA成像过程[27],但它并没有得到广泛的临床应用。
DSA仪器
[edit | edit source]- 图 7.5 显示了用于DSA的成像系统的框图,该系统基于XII视频技术。可以看到,来自摄像机的图像被馈送到数字图像处理器以进行处理、存储和显示。为了实现脉冲曝光操作模式,图像处理器和摄像机以及高压发生器之间需要控制连接。这些控制连接用于指示高压发生器启动每次曝光脉冲并选择摄像机的适当操作模式。系统通常包括XII和摄像机之间的可变光学光圈。请注意,出于清晰度的考虑,图中未包含此设备。

- 用于脉冲曝光DSA的强辐射曝光会在XII输出端产生相对明亮的图像。由于此类明亮的XII图像很可能使摄像机(通常对光具有很高的敏感度)饱和,因此通常使用光圈来控制摄像机靶的照明。在用于患者定位的荧光透视曝光期间,光圈设置较宽,而在DSA曝光期间设置较窄。光圈的精确设置取决于具体的检查,通常由数字图像处理器自动设置。
- DSA需要大功率X射线发生器和XRT。因此,使用可以产生高达100 kV、1000 mA的曝光量的发生器,曝光时间非常短,并且使用具有高热容量和小型焦点的XRT,例如0.5 mm。发生器还应能够产生用于导管引导和患者定位目的的低连续曝光。
- 脉冲曝光DSA需要专用摄像机。影响其设计的一个因素是需要低噪声组件,如前所述。这可以通过使用基于二极管配置的电子枪的摄像机来实现。这种设计允许使用相对较大的电子电流来扫描摄像机靶,从而产生低噪声图像。已经发现,需要具有大约60 dB (1000:1) 的信噪比的摄像机。
- 影响脉冲曝光DSA摄像机设计的第二个因素是需要生成具有良好时间分辨率的图像。因此,摄像机靶应由低残留或换句话说,低滞后的材料制成。这种靶材可以使用氧化铅来获得,就像在Plumbicon摄像机中一样。使用这种靶材的另一个优点是它的传递特性具有单位增益 - 这有利于后续的图像数学处理。
- 最后,高分辨率摄像机已在DSA中得到应用。其中包括1049线Plumbicon和CCD摄像机,以高达25帧/秒(fps)的速度生成1024 x 1024 x 10位图像,以及2099线Plumbicon,以高达7.5 fps的速度生成2048 x 2048 x 10位图像。
DSA图像处理器
[edit | edit source]- 图 7.6 显示了DSA图像处理器的框图。可以看到,来自XII视频图像接收器的视频信号使用模数转换器 (ADC) 进行数字化,并将得到的数字数据在存储到其中一个图像存储器之前,通过输入查找表 (ILUT)。ILUT通常用于对获取的图像进行对数变换。需要注意的是,在一些系统设计中,对数处理是使用图像存储器和ALU之间的查找表来执行的,以便显示的未减影图像以其传统的非对数格式显示,而减影图像则应用了对数变换。

- 常规DSA至少需要三个图像存储器 - 一个用于掩模图像和实时图像,第三个用于减影图像,尽管大多数系统都有存储超过三个图像的能力。图像减影使用算术/逻辑单元 (ALU) 来执行,减影图像数据沿着反馈路径馈送,以便可以将其存储在图像存储器中。ALU还可以用于对图像进行平均化以降低噪声。
- 图中所示的图像处理器类型也可以用于实现 DSA 成像基本主题的多种变体。其中一种变体被称为时间间隔差 (TID) 成像,它涉及在 DSA 研究期间定期更新掩模图像存储器的内容。这种方法允许显示图像之间的短期变化,因此适用于对快速移动事件(如心脏收缩)进行成像。
- 另一种变体涉及在患者的同一区域(例如,颈动脉 和颈静脉)获取动脉和静脉血管的图像,这样当从静脉期的实时图像中减去动脉期的掩模图像时,就可以生成显示动脉和静脉血管的减影图像。第三种变体被称为路标 - 见图 7.7 - 其中使用峰值增强的图像作为掩模,随后在不注射额外的造影剂的情况下,使用减影图像来引导导管或导线的推进。

- DSA 的一些特定图像处理包括
- 重新掩模:此过程用于减少减影图像中的运动伪影,这些伪影是在掩模图像和实时图像的获取之间患者移动时产生的 - 见图 7.8。该过程通常涉及在图像获取后交互式地选择更合适的掩模图像,以最大程度地减少显示的 DSA 图像中运动伪影的影响。
- 重新配准:此过程也用于减少 DSA 图像中的运动伪影,通常称为像素偏移。该过程涉及将掩模图像相对于实时图像以小增量空间偏移,以实现对两个图像共有的特征的改进配准。在操作员交互下,可以实现垂直和水平偏移,其量级为像素的一小部分。阵列处理器可用于以所需的速率执行必要的计算和图像偏移。然而,由于投影身体运动的复杂性,简单的垂直和水平偏移不太可能消除图像中的所有运动伪影。但是,这种方法通常对图像内的孤立区域很有用。
- 地标:此过程用于在减影图像中提供解剖学地标。它通常通过不是减去整个实时图像,而是减去其强度的一小部分(例如 90%)来实现,再减去掩模图像。
- 空间增强:此过程用于改善减影图像的美观外观,以便血管边缘以更高的突出度显示(例如,边缘增强)或抑制图像中的急剧过渡(例如,图像平滑)。阵列处理器可用于以高速执行必要的计算。

- 量化:此过程用于从 DSA 图像中提取定量信息。通用计算机与专用软件一起用于此目的。两种通用方法已得到应用。一种方法被称为几何分析,它涉及测量图像中感兴趣点之间像素的数量或图像中指定区域内的像素数量。例如,在此基础上,血管中的狭窄区域可以参考血管的非狭窄区域,或者可以在收缩期和舒张期图像中比较左心室的投影面积。此外,在进行适当的图像校准后,可以以传统的测量单位(例如 mm 或 cm)计算距离。第二种方法被称为密度分析,它涉及计算图像增强区域中的平均像素值。例如,心脏射血分数和狭窄也可以使用这种方法进行评估。这两种方法通常依赖于对血管和心腔边缘的准确确定。因此,大多数量化软件还包含有助于可重复边缘定位的功能。请注意,几何和密度分析也可能涉及重大的测量伪影。在几何情况下,这些主要来自成像过程引入的空间畸变。在密度情况下,它们主要来自散射辐射和眩光的贡献 - 因此,如前面讨论的,需要应用校正技术在需要准确测量的场合。
- 其他过程包括剂量追踪、旋转血管造影和体积断层血管造影。剂量追踪[28]已被证明对周围血管造影特别有用,例如。在此,对比介质的进展被自动跟踪,并用于将床台和/或 XRT/图像接收器移动到下一个解剖区域。随后的减影图像集可用于构建周围血管的合成图像。在旋转血管造影[29]中,例如,C 形臂组件可以在成像序列期间以每秒 10-30 度的速度旋转。随后对减影图像的动态显示可以用于生成感知的 3D 演示,以便可以更容易地理解血管内的复杂关系。体积断层血管造影[30]类似于计算机断层扫描 (CT),其中 C 形臂在成像序列期间围绕患者旋转。图像数据经过体积重建算法处理,该算法允许生成增强血管的三维图像。我们将在下面更详细地讨论此后一个过程。
锥形束计算机断层扫描
[edit | edit source]
传统放射摄影基于 X 射线束被不同组织衰减,并用于将阴影投射到图像接收器上。本质上,这些图像是在二维平面上投影三维物体。因此,很难识别小病变,由于放大效果不均匀,图像会发生畸变,而且由于散射对图像形成有很大贡献,因此低对比度的肿块很难区分。此外,如图 7.9 所示,图像中引入了一种退化,即两个解剖结构完全不同的物体可能会产生相同的图像对比度,因为它们各自产生的有效衰减相同。简而言之,信息损失很大。
可以使用计算机断层扫描 (CT) 改善这种情况。它最初是作为一种放射摄影技术而开发的,通过使用窄扇形 X 射线束从多个方向扫描组织切片来产生横截面图像。计算每个组织元素的衰减并转换为显示在显示器上的灰度。CT 扫描的基本原理是,可以通过对物体的多个投影进行重建来重建物体的内部结构。约翰·拉东早在 1917 年就建立了这一原理,而艾伦·科马克在 1963 年和 1964 年发表了关于图像重建的工作。在 1970 年代初期,戈弗雷·豪斯菲尔德利用计算机技术应用了这些概念,并将它们用于诊断成像[31]。正如他们所说,历史的车轮滚滚向前!
我们将从这里开始我们的处理,考虑单个断层扫描切片的图像形成,然后将这些概念扩展到描述锥形束断层扫描。
图像重建基础
[edit | edit source]
- 通过将身体划分为许多称为体素的小体积元素,获得称为身体断层扫描切片的横截面层 - 见图 7.10。当在计算机屏幕上显示时,每个体素在二维上由像素表示。CT 中的任务是为每个体素分配一个与它的 X 射线衰减成比例的数字。这可以通过旋转 XRT 和一组探测器围绕感兴趣的切片来实现,以测量围绕该切片的不同角度的辐射强度。换句话说,获取了围绕切片的多个视图。然后将图像重建算法应用于此投影数据,以估计每个体素中的衰减。体素的衰减量由它的成分和大小以及 X 射线能量决定,并通过一个参数(可以用豪斯菲尔德单位,HU 表示)来表征,该参数源自线性衰减系数,μ。
- 可以应用许多图像重建方法。但是,我们感兴趣的是称为滤波反投影 (FBP) 的方法。

- 反投影的基本前提是,从射线源到探测器的路径上,X射线束的任何衰减都是均匀发生的。为了说明计算方法,让我们考虑一个简单的断层扫描切片,其中仅包含四个体素 - 见图 7.11。第一个投影 P1 是从图中从左到右的水平曝光获得的。P1 的反投影涉及将值 7 和 9 分别放入第一行和第二行的两个元素中。第二个投影 P2 在反投影时,将 4 添加到右上角元素,将 1 添加到左下角元素,将 11 添加到其他两个元素。其他投影以类似的方式处理。在对数据集进行正则化后,最终图像将出现在图的左下方。
- 图 7.12 中的表示展示了该原理的实际应用。一个单一投影被反投影到整个图像平面上,形成一条暗条纹 - 见图 (a)。当从不同的角度扫描体模并将投影从多个方向反投影到图像平面时,不透明物体的图像开始出现 - 见图 (b)。随着投影数量的增加,图像质量会提高,但始终会存在图 (c) 中所示的“条纹”。仍然会存在一定程度的虚假背景信息,这会严重降低重建图像的质量。从数学角度来看,图像由于与距离 r 的 1/r 函数依赖关系的卷积而变得模糊。换句话说,点扩散函数 (PSF) 具有 1/r 依赖性,这完全归因于反投影过程。

- 使用一种称为滤波反投影 (FBP) 的改进的反投影形式可以显著提高图像质量。在这种技术中 - 见图 7.13 - 投影数据首先在空间上进行滤波,以考虑由于简单反投影中的突然密度变化引起的条纹效应。该滤波器被称为卷积滤波器或核。该过程可以使用傅里叶变换 (FT) 方法在空间频率域中执行,也可以使用空间域处理直接执行。在卷积过程之后,每个投影的数据在进行反投影计算之前进行逆傅里叶变换。在实践中,图像重建任务使用特殊的阵列处理器和专用硬件执行,这有助于加速重建任务。


- 通常可以选择多种滤波器来增强图像中的软组织特征或骨骼细节。事实上,如果需要,可以在扫描完成后使用不同的滤波器对图像进行后期处理。可以生成图像以增强骨骼细节或显示细微的低对比度病灶,而无需重新扫描患者。因此,滤波器选择对图像质量有重大影响。X射线 CT 中使用的两种最常见的滤波器是由于拉马钱德兰和拉克希米纳拉亚南(通常称为Ram-Lak)和谢普和洛根。在空间频率空间中,前者本质上是一个截止频率为斜坡滤波器,而后者将平滑滤波器与斜坡滤波器结合起来以衰减高频噪声。斜坡滤波器补偿了简单反投影过程引入的伪影,但没有补偿数据随着频率增加而增加的噪声含量。在图 7.14 中可以看到使用软组织算法和骨骼算法重建的轴向断层图像。
C形臂 CT
[edit | edit source]- C形臂透视系统可以使用在患者周围不同角度获取的图像来实现反投影[32]。X射线束被准直成一个大锥形,XRT 和图像接收器作为一个整体旋转以从大量切片同时获取投影。通常应用一种称为Feldkamp算法的近似反投影重建技术。结果是在患者周围一次旋转中获得完整的 3D 图像采集。多探测器 CT (MDCT) 扫描仪使用这种方法,并配备了探测器阵列(例如 64 行和 800 列) - 有时被称为多探测器行扫描仪。C形臂透视系统也使用广域图像接收器,但尺寸要大得多,例如 1,920 像素,2,480 列。

- 因此,C形臂系统可以同时获取大量投影的数据。然而,一个缺点是,使用广域曝光成像会产生大量的散射辐射[33],因此断层图像在低物体对比度方面的分辨率能力不及 MDCT 可实现的水平。因此,应用计算机散射校正来解决这个问题。另一个缺点是,Feldkamp 算法仅对小视场有效,例如头部和颈部。将其应用于更大的身体区域涉及处理截断的投影,这可以使用更复杂的计算方法来解决[34]。
- 类似的设计也已在牙科放射学中得到应用[35]。
- C形臂 CT 的成像几何形状如图 7.15 所示。XRT 和图像接收器在患者周围的不同角度拍摄图像,放大倍率约为 1.5。已发现 150-200o 的部分旋转就足够了 - 而不是像螺旋 CT 中的完整 360o。此外,旋转可以在轨道平面和斜平面中进行。通常使用每秒 30o 的旋转速度和每秒 7.5-10 帧的成像帧速率来获取 50 个或更多 2D 投影。
- 在神经血管造影中,数据采集通常涉及两个旋转运行 - 一个在造影剂注射之前,另一个在造影剂注射之后。造影剂注射前的采集称为Mask运行,而造影剂注射后的采集称为Fill运行。由此产生的 3D 数据集可以进行减法(类似于 DSA),以形成用于图像重建的造影剂数据。可以生成非常详细的脑血管图像,如下面的电影所示。
- 可以使用这项技术通过将实时 2D 图像叠加在不透明血管的 MIP 投影上实现 3D 路线图。可以与先进的系统连接以实现引导,例如,用于电子手术工具。然而,这些主题超出了本维基百科的范围。
多探测器计算机断层扫描 (MDCT)
[edit | edit source]图7.1.5.1展示了从计算机断层扫描 (CAT) 时代开始,多层螺旋CT (MDCT) 的发展历程。Hounsfield最初的平行铅笔束、平移-旋转扫描方式,被窄扇形束扫描仪(第二代)所改进,后来又进一步发展为宽扇形束、旋转-旋转扫描(第三代)。早期的EMI扫描仪设计中,图像是在轴向平面获得的,每次扫描同时获取两层,厚度为8-13毫米。头部扫描时间约为5分钟,扫描仪生成非连续的180°扫描,患者床在解剖兴趣区域内逐步移动。第三代设计中,集成了一个弯曲的线性阵列,包含多达896个探测器元件(del),每个元件间隔约1毫米,以及一个完全覆盖患者身体的扇形X射线束。这使得扫描时间大幅减少。X射线管和探测器阵列以高速绕患者旋转,照射厚度为1-10毫米的解剖层。此外,使用患者前后准直获得了极佳的对比度区分。另外,为了使曝光量均匀化并降低视野外围的患者剂量,使用了与身体或头部形状相匹配的弓形滤波器。
 |
 |
 |
 |
由于从患者相反两侧收集的投影数据理想情况下应该生成相同的投影数据,因此对第三代设计进行了许多改进。换句话说,一半的扫描数据是冗余的。这些改进包括飞焦X射线管,它允许电子束在每次投影采集过程中交替地在两个离散焦点之间切换。这两个焦点在阳极上的位置相差半个探测器元件的间距。在此基础上,通过交织两个投影的数据,可以将独立投影的数量(或等效地,探测器元件的数量)增加一倍。使用这种技术,一种扫描仪设计可以将有效的探测器元件数量从768个增加到1536个。
考虑到窄束几何形状,与二维投影射线照相相比,CT中的散射水平相对较低。这一特性使得应用密度分析来评估脑灌注[36],并评估例如腰椎骨的骨密度(BMD)[37]成为可能,例如在定量CT (QCT) 中。
CT图像显示
[edit | edit source]- 在使用滤波反投影(FBP)重建计算每层每个体素的线性衰减系数后,将这些值归一化到水值的参考值,然后进行缩放,并以豪斯菲尔德单位(HU)呈现,也称为CT值,如下所示
- 其中μm和μwater分别是组织材料和水的线性衰减系数。因此,水的CT值为零。下表显示了一些组织的CT值。
| 组织 | CT值 (HU) |
|---|---|
| 肺 | -300 |
| 脂肪 | -90 |
| 白质 | 30 |
| 灰质 | 40 |
| 肌肉 | 50 |
| 松质骨 | 300-500 |
| 皮质骨 | 600-3,000 |
- 重建的图像可以在计算机屏幕上使用灰度级显示。通过选择合适的窗位和窗宽,可以将灰度级选择为包含所有或部分CT值范围。窗宽是显示的CT值范围,窗位通常是选择窗口的中心CT值。通常,最高值分配给白色,最低值分配给黑色,所有中间值分配给线性比例上的强度。因此,空气可以显示为黑色,皮质骨看起来相对明亮。
- 上面两个图展示了图像显示操作的例子。在图7.15.2中,同一张通过患者肝脏切片的图像使用相对窄的窗口(高对比度)和宽的窗口进行显示。窄窗口的图像看起来更嘈杂,但这仅仅反映了灰度级分布在狭窄的CT值范围内这一事实。
- 图7.15.3说明了使用相对窄的窗口来突出显示肺部的病理。
螺旋CT
[edit | edit source]
- 螺旋扫描,如图17.15.1的(d)面板所示,是在患者床沿扫描仪的颅尾方向(z轴)连续移动的基础上发展起来的。轴向切片通过插值在z轴上生成,然后进行滤波反投影 (FBP) 重建。床速为1-10毫米/秒,在半秒或更短的时间内完成360°旋转,扇形束准直到1-10毫米厚。引入了一个新的扫描参数,称为螺距,它定义了单个旋转中床的移动距离与层厚的比率。因此,床移动距离为10毫米,层厚为10毫米将生成螺距为1。螺距值在0.5-2之间,具体取决于沿z轴所需的空間分辨率,小于1的值(例如0.8)可以提供足够的重叠层,以便进行3D可视化。由于解剖结构正在被扫描,因此数据集中没有间隙,这与传统的轴向扫描形成对比,在传统的轴向扫描中,除非专门选择扫描连续切片,否则会产生切片间间隙。
- 由于患者床和机架之间的相对运动,有效层宽由层敏感度曲线 (SSP) 给出,大于名义层宽,因为层剖面因与床运动相关的三角剖面进行卷积而变得模糊 - 请参见图7.15.4。然后应用使用z插值技术的软件改进,以最大程度地减少SSP的这种展宽[38]。例如,可以将线性插值应用于来自相邻螺旋扫描的180o和360o序列,以获得所谓的180LI和360LI,或Slim和Wide处理算法。但是,无论使用哪种插值技术,增加螺距都会导致有效层宽增加。
- 由于可以快速、连续地扫描解剖结构的大部分,并且患者运动的影响很小,因此检查时间显著减少。例如,可以在60秒的连续扫描中扫描多达80层 - 请参见图7.15.5中的示例。在此基础上,单次屏气扫描成为可能。此外,可以生成各向同性的体素尺寸,即在所有三个轴上尺寸相等,而不是单层扫描的矩形体素,从而可以重建矢状面、冠状面、弯曲平面、离轴和3D图像。在扫描体积内,可以任意位置和间距重建图像,层宽通过准直控制。一个重要的区别是,用于重建的后续切片的位置和间距可以在事后确定,而无需重新扫描患者。例如,可以生成薄层(例如,<3毫米),重叠率为80%,以便重建精美的3D图像。
多层螺旋CT
[edit | edit source]- 随后体积成像的扫描速度的提高产生了多探测器扫描(MDCT)等技术进步。最初,大约在1998年,使用二维探测器阵列,z轴长度为20-32毫米,能够同时扫描厚度为0.5-10毫米的四层 - 请参见图7.15.7。例如,通过将X射线管、高压发生器和探测器阵列安装在同一个旋转机架上,可以实现半秒或更短的扫描仪旋转时间。速度的提高以及管负荷的降低,发现仅会导致患者剂量略微增加。在此基础上,开发了诸如ECG门控心脏研究、冠状动脉钙化评分、虚拟结肠镜检查和CT血管造影 (CTA) 等技术。
- 需要注意的是,原始的EMI扫描仪使用两个铅笔束,因此是两层扫描仪 - 因此可以认为是第一台多层扫描仪。
- 从螺旋扫描中进行轴向插值的算法得到了发展,例如多层线性插值(MLI),例如180MLI和360MLI,并且通过使用应用自适应轴向插值的z过滤过程得到了增强,例如多层滤波插值(MFI),例如360MFI。

- 二维探测器阵列是固态器件,最简单的例子是矩阵阵列,如图17.5.8所示。例如,阵列可以由912列16行组成,每个1.25毫米见方,弯曲以适应XRT旋转的弧线。图中(a)面板显示了其中的八列,被6毫米宽的X射线束照射,结果可以同时获取四层1.25毫米厚的轴向切片的数据。当X射线束扩大到包含探测器阵列的宽度时,可以同时照射更多行,在这种情况下最多可以照射十六行。可以通过耦合相邻探测器行的输出,在该设计中构建灵活性,如图(b)、(c)和(d)所示,其中分别将2、3和4行的输出求和,以同时生成四层2.5毫米厚的切片,或者四层3.75毫米厚的切片,或者四层5毫米厚的切片。
- 自适应阵列探测器提供了一种更加灵活的设计,如图7.15.9所示。该阵列不像方块探测器列,而是使用宽度可变的探测器列,使得两列中央列的宽度相对较窄,例如图中所示的1毫米,列宽向外围逐渐增加,例如从1.5毫米到2.5毫米,再到5毫米,如图所示。
- 图7.15.10显示了这种类型探测器阵列的四种操作模式。可以从(a)面板中看出,当1毫米厚的X射线束与自适应阵列的中央列对齐时,可以获取两层0.5毫米厚的切片。在(b)面板中,可以使用4毫米厚的射线束获取四层1毫米厚的切片。探测器耦合在(c)和(d)面板中得到说明,其中四列中央列中探测器的输出被耦合,以模拟两列2.5毫米宽的检测列,从而获取四层2.5毫米厚切片的数据。
- 自适应阵列的第二个优点是,每行单个探测器单元的数量可以显著减少,在刚刚讨论的例子中,从16个减少到8个。这极大地提高了阵列生成数据的速度,并减少了对测量数据进行均匀性和其他校正所需的计算次数。
多探测器CT
[edit | edit source]- 随着例如具有16层(2001年)、64层(2004年)、128层(2005年)甚至320层(2007年)切片能力的MDCT系统的开发,Z轴覆盖范围得到了进一步扩大,扫描时间也得到了进一步缩短。在此基础上,扇束CT演变成了锥束CT,其中X射线束被准直成一个矩形锥,因此旋转的XRT/探测器组件可以从多层螺旋扫描中生成图像数据[39]。此外,扫描仪旋转速度快至0.3秒或更短,允许以0.25毫米的切片厚度捕获心脏的3D图像,并添加了第四维(4D)。
- 机架是CT扫描仪的重要设计元素,其旋转部件会受到与高速旋转相关的强大离心力的影响。例如,在半径40厘米、旋转速度不到半秒的旋转情况下,可能会感受到高达10G的力。因此,需要精确的平衡,尤其是在机架倾斜以进行斜向采集时。
 |
 |
- CT被认为是要求更高的X射线管应用之一。最值得注意的是,随着单次呼吸暂停成像(最长可达一分钟)的出现,X射线管和外壳必须能够快速消散巨大的热负荷。例如,以133 kVp和250 mA工作60秒的X射线管会在阳极中沉积约2 MJ的能量。可以通过使用热交换器来提高冷却速率,例如,软件通常会限制XRT的误用。
- 一种使用液态金属轴承来提高阳极旋转速度的XRT设计被引入,但旋转外壳XRT的开发取得了重大设计突破。在这里,电子束可以在一个小型旋转金属管内使用外部电磁体聚焦和偏转[40]。例如,STRATON XRT获得了卓越的冷却速率。此外,对电子束的精确控制允许在z方向上实现飞聚焦原理。结果,例如,可以从两次32层、6毫米厚的同步采集中生成64层3毫米厚的切片。但是,使用这种技术,每次曝光到达探测器的光子更少,因为光子被分成两个焦点。
- 通常使用X射线束的患者前和患者后准直来减少散射辐射。现代探测器可以使用磷光材料条带制成,例如CdWO4、Gd2O3和Gd2O2S,耦合到a-Si光电二极管阵列。超快陶瓷(UFC)探测器由掺杂的氧化硫化钆制成,形为多晶晶片。这些器件具有相对快速的响应速度,从而提高了采样率,以及高检测效率和宽动态范围。矩阵阵列和自适应阵列都可以在64层扫描仪中使用。
- 通常使用患者定位系统生成后续重建过程所需的精确位置数据,尤其是在螺旋扫描期间。该系统还可以使患者定位在扫描仪的等中心,并且通常使用激光束指示患者的照射区域。
- 临床应用的图像重建形式包括
- 重新排序算法:这些算法包括针对64层CT中小型锥角优化的算法,例如高级单层重新排序(ASSR)。该计算通过最小化重建平面与每个重建位置螺旋线的偏差,将三维锥束数据减少到倾斜的二维切片。它已在16层和64层CT扫描仪中得到应用。然后使用滤波反投影(FBP)将数据排序成角度轴向切片。最后,将这些倾斜切片插值到平行轴向切片。例如,自适应多平面重建(AMPR)和加权超平面重建(WHR),可以使用专用硬件以相对较高的速度实现。
- 近似算法:这些算法通常是Feldkamp算法的扩展,用于将3D滤波反投影扩展到多层螺旋扫描。平行轴向图像直接从原始投影数据中获得。例如,锥束重建算法(COBRA)算法和真锥束断层扫描(TCOT)重建,需要相当大的处理能力才能以高速实现。
- 大多数重建算法需要180o投影数据来重建螺旋采集中的第一张和最后一张图像,以确保重建感兴趣的解剖部分。这个过程被称为过扫描,它会导致患者的总体照射量增加。当使用低螺距扫描小体积时,它的贡献相对较高,例如内耳检查。可以使用自适应患者前z准直来减少这种影响,方法是使用相对的准直器叶片,这些叶片在螺旋扫描开始时自动打开,并在扫描结束时关闭。
- 自动曝光控制(AEC)通常通过根据患者解剖结构的大小、形状和成分来调节mA来实现,以便在整个扫描过程中保持图像噪声恒定。使用平面内(xy轴)和纵向(z轴)mA调制。
- 可以使用64层螺旋MDCT扫描和慢速床台移动来获取心脏图像,以便来自180o机架旋转的投影数据可以在空间和时间上捕获足够的图像数据,即使在心律不规则的患者中也是如此[41]。可以使用螺距为0.15-0.25的心电门控采集,这会使辐射剂量增加,尽管也可以使用前瞻性门控采集,这可以减少患者的照射量。使用320层系统扫描可以用来克服这类问题,方法是直接覆盖整个心脏。有关心脏CT的更多详细信息,请参阅Halliburton(2009)[42]以了解更多详细信息。
CT透视
[edit | edit source]- CT透视(CTF)也被称为连续CT或实时CT,因为它涉及以足够高的帧速率生成断层图像,以便指导在小或深部病变中进行穿刺置针。应用包括胸部病变活检、盆腔病变活检/引流、椎体成形术以及颅内血肿的引流/抽吸。CTF的优势包括目标精度提高和操作时间缩短[45]。
- 与传统CT系统的主要区别在于应用了高速重建技术,并且在扫描室内安装了操作面板、曝光脚踏开关和图像监视器,供介入医生使用。通常可以使用床台移动、机架倾斜、激光网格定义和透视因素的控制。另一个重要的操作变化与管电流的选择有关,在CTF中,管电流通常为30-50 mA。这应该与传统透视术中使用的典型筛选电流(高达5 mA)进行比较,因此CTF可以被认为是一种高剂量操作。在这种情况下,可以为CTF操作自动引入额外的束滤器,例如,将患者的照射量减少高达50%。此外,使用防护手套和穿刺针架可以减少介入医生手部的辐射照射。

- 最初用于CTF的快速重建算法使用了一种部分(或增量)重建技术。它利用了CTF图像序列中每张图像都包含该序列中之前图像的大量数据这一事实,因为正在连续扫描相同的切片。图像重建过程如下
- 来自第一次 360o 旋转的原始数据通过滤波反投影重建并显示;
- 完成接下来的 No 次扫描后,执行相同的处理并用于更新显示的图像;并且
- 该过程在整个过程中持续重复。
- N 的值通常为 30o、45o 或 60o,相应的帧速率分别为每秒 12 帧、8 帧和 6 帧。对于 60o 更新和每秒 6 帧的情况,每张图像之间的延迟为 0.17 秒。在图像被更新时,可以使用“最后一帧保持”(LIH) 技术,介入医生需要考虑由此产生的时间延迟对活检技术的影响。示例图像如图 7.15.11 所示。使用 MDCT 扫描显示三个相邻的 5 毫米厚切片可以提高介入医生在针头前进时的视觉反馈。此外,多平面重建 (MPR) 和体绘制 3D 图像可用于增强精细控制。
- 迭代重建也可以应用于 CTF,以提高图像质量并减少患者暴露。此外,诸如角束调制 (ABM) 之类的技术,其中 X 射线束在靠近注射部位的 XRT 旋转过程中关闭 120o,可以显著减少患者剂量以及介入医生手部的剂量[46]。患者身上的铅帘可用于减少散射辐射,移动辐射屏蔽可用于额外的辐射防护。
迭代重建
[edit | edit source]- 这是在原始 EMI 扫描仪中采用的方法,但后来被更快的分析技术所取代,例如滤波反投影 (FBP)。然而,21 世纪头十年的计算机硬件和算法的发展使迭代重建在计算机断层扫描的临床应用中得以重生。
- 重建过程如图 7.15.12 所示,用于包含一个 2x2 像素矩阵的简单图像。它从一个解的猜测开始,然后将实际投影与根据猜测获得的投影进行比较。对像素值进行修改,并重复该过程。重复迭代直到测量投影和计算投影之间的差异变得微不足道。
| 投影 | '患者' | 加性迭代重建 |
|---|---|---|
| P1 |  |
 |
| P2 |  |
  |
| P3 |  |
  |
| P4 |  |
  |
- 图像矩阵的第一个估计值是通过将第一个投影 P1 均匀分布到一个空的像素矩阵中来进行的。然后,将第二个投影 P2 与估计矩阵中的相同投影进行比较,并将实际投影和估计投影之间的差异添加到估计矩阵中。对所有其他投影重复此过程。
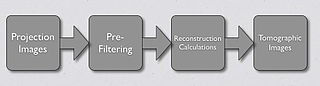
- 以下图表说明了整个 FBP 过程
- 诸如自适应统计迭代重建 (ASIR) 之类的重建算法的开发基于使用 FBP 图像本身作为初始猜测,然后混合 FBP 和 IR 重建[47]。ASIR 和类似的算法,例如图像空间迭代重建 (IRIS),能够选择性地识别噪声,以便从图像数据中减去其贡献并生成比 FBP 质量更高的 CT 扫描。该功能可以被利用来减少剂量,并且已经报道了实质性的减少,例如 23-66%[48]。另一种方法称为基于模型的迭代重建,其中将 CT 成像过程的物理模型纳入迭代中。Love 等人 (2013)[49] 和 Stiller (2018)[50] 对这两种方法进行了比较。
- 许多这些计算都基于最大似然期望最大化 (ML-EM) 算法,其中使用除法过程来比较实际投影和估计投影,如下所示

- 数据通过此处理链的一个循环称为一次迭代。有序子集期望最大化 (OS-EM) 算法可以通过在迭代过程中按顺序使用有限数量的投影(称为子集)来显著减少计算时间。在重建过程中产生的噪声可以减少,例如,使用内置于重建计算中的高斯滤波器或作为后滤波器应用

最后一点,应该认识到,除了螺旋扫描之外,许多当代计算机断层扫描发展背后的概念起源于其临床应用早期的工作[51]。
双能放射成像
[edit | edit source]双能成像可用于消除图像中的骨骼信息,从而获得仅显示组织的图像。或者,该技术可用于产生相反的效果,其中消除组织信息并生成仅显示骨骼的图像。后一种选择理想地允许分析骨骼的密度。下面将首先介绍这种成像技术的理论背景,并讨论其发展方向,最后将讨论双能 X 射线吸收测定法 (DEXA)。
双能物理基础
[edit | edit source]
- 双能成像基于利用组织和骨骼在不同 X 射线能量下的衰减差异 - 见图 7.16。它通常涉及在两种 X 射线能量下获取图像并处理它们以抑制骨骼或组织信息。与之前为 DSA 开发的简化数学模型类似,假设使用单能辐射,并且不再检测散射辐射,因此,在低 X 射线能量下获取的骨骼和组织区域的透射辐射强度,以及对数变换后,可以给出为
- 其中
- μtl 是组织在低 X 射线能量下的线性衰减系数,
- xt 是组织厚度,
- μbl 是骨骼在低 X 射线能量下的线性衰减系数,以及
- xb 是骨骼厚度。
- 类似地,在较高 X 射线能量下获取的同一区域图像的透射辐射强度由下式给出
- 其中
- μth 是组织在较高 X 射线能量下的线性衰减系数,以及
- μbh 是骨骼在较高 X 射线能量下的线性衰减系数。
- 当这些图像乘以单独的加权因子 kl 和 kh,并将结果组合起来形成一个合成图像时,结果由下式给出
- 因此
- 这表明可以通过将 xt 的系数设置为零来实现组织抵消,即
- 我们可以改写这个方程得到
- 因此
- 这意味着当权重因子之比选择等于两种X射线能量下组织衰减系数之比的负值时,组织可以从合成图像中消除。类似的方法可用于通过将 xb 的系数设置为零来实现骨骼消除。
- CR 和 DR 图像接收器通常可以用于双能 X 射线成像,采用以下两种配置之一:
- 双重曝光:在患者移动不是问题的应用中使用两次单独的曝光;以及
- 单次曝光:其中两个图像板通过滤光片隔开,安装在双能盒中,以在前面的图像板上记录低能图像,而在另一个图像板上记录高能图像。
- 图像数据处理的形式如图 7.17 所示。
- 在图的左上角面板中显示了以 56 kV 获得的胸部 X 射线照片。这被称为低能图像。右上角面板是同一患者胸部在高能(120 kV,带有 1 毫米铜滤光片)下拍摄的 X 射线照片。双能处理的结果显示在底部的行中。骨骼减影图像显示在左下角面板中,组织减影图像显示在右下角面板中。请注意,组织减影图像表明患者左肺中的病灶是钙化结节,因为它没有出现在骨骼减影图像中。图 7.17a 中显示了两种不同千伏值的模拟 X 射线光谱,以说明使用这些曝光参数可以实现的能量分离。
 |
 |
|---|---|
 |
 |
- DECT 提供了在重建图像之前通过调整两组原始 CT 数据的混合,利用两种不同 X 射线能量的 CT 采集来区分组织、骨骼和造影剂的能力。已经开发出多种方法来生成这些数据集:
- 双源 CT:两个 X 射线管,具有不同的千伏值和束滤波器(例如,参见图 7.17b 中的光谱),
- 单源 CT,使用单个 X 射线管在两种千伏值之间快速切换,
- 单源 CT,使用双层探测器,其中钇基闪烁体用于低能量,钆基闪烁体用于高能量(参见图 7.17c 中的比较衰减数据),
- 单源 CT 管,带有分体滤波器,
- 单源 CT,进行顺序双能扫描和图像空间配准。
- Goo & Goo,2017[55] 对这些技术的概述及其临床应用进行了介绍。
- 双能 X 射线吸收测定法 (DEXA) 起源于 核医学 程序,其中使用两种伽马射线能量的透射来确定骨矿物质密度。该程序被称为双光子吸收测定法,通常使用同位素 153Gd,它发射 44 和 100 keV 的伽马射线。由于光子通量和实际考虑因素的限制,DEXA 技术中放射性源已被 X 射线管取代。该技术已在 骨质疏松症 的评估和监测中得到广泛的临床应用,并在准确性、精确度和辐射剂量方面超越了主要的替代技术,即定量计算机断层扫描 (QCT)。

- 已经开发出两种生成适当 X 射线能量的一般方法。在一种技术中,在图像采集过程中快速切换千伏值和滤波器,例如,从 70 kV 和 4 毫米铝滤波器切换到 140 kV,并增加 3 毫米铜滤波器。在第二种技术中,使用单一的 X 射线能量和两种不同的滤波器,例如,80 kV,分别使用不添加滤波器和 铈 或 钐 滤波器。铈在 40.4 keV 处有一个 K 吸收边,钐在 46.8 keV 处有一个 K 吸收边,两种材料都生成与未滤波光谱相比更硬的光束。
- DEXA 技术通常涉及一个 X 射线管和一个 闪烁探测器,安装在 C 形臂装置上 - 参见图 7.18 - 使患者暴露在以直线方式扫描的铅笔形 X 射线束中。铅笔形光束用于减少散射辐射的检测,闪烁探测器通常由 CdWO4 或 NaI(Tl) 闪烁体组成,耦合到光电探测器。滤波器组件用于在适当的间隔内将滤波器和校准标准切换进出铅笔形光束。这种方法的扫描时间约为 2 到 5 分钟,具体取决于检查,在使用扇形 X 射线束和探测器阵列的第二代仪器中,扫描时间会缩短。通过在第二代设备中扫描期间旋转 C 形臂围绕患者,可以形成 CT 图像。闪烁探测器的输出被馈送到计算机,用于双能数据处理和图像显示。可以从图像数据中推导出许多身体成分参数,例如 骨矿物质密度 和软组织成分。
- 请注意,即使与胸部 X 射线摄影相比,DEXA 中的患者剂量也是微不足道的[56]。
相关成像广泛应用于医学诊断,以便将从多种成像方式中获得的信息合并起来,形成患者病情的更全面的图片。通常需要在融合过程之前对图像数据进行空间对齐,以解决方向、放大率和其他采集因素方面的差异。这种对齐过程通常被称为 图像配准。
- 假设我们要配准两幅图像 - 一幅平面核医学扫描图像和一幅 X 射线照片,如图 7.19 所示。
- 配准过程通常假设两幅图像中的空间位置之间存在对应关系,以便可以建立坐标转换函数 (CTF),该函数可用于将一幅图像中的位置映射到另一幅图像中的位置。在上面的示例中,就像许多临床情况下一样,需要先解决许多兼容性问题。明显的一个问题是图像采集使用的不同方案,即骨扫描的掌面视图和后前 (PA) 投影 X 射线照片。我们可以在示例案例中通过从骨扫描中提取右手数据,然后将其镜像来处理此问题。当使用不同的数字分辨率时,会出现一个相关问题 - 在这种情况下,核医学图像使用 256 x 256 x 8 位分辨率获取,而 X 射线照片使用 2920 x 2920 像素矩阵和 12 位对比度分辨率获取。

- 当我们假设两幅图像中的空间失真最小且定位相同,我们可以推断出空间均匀的 CTF,即应用于一个像素的变换也可以应用于所有其他像素。让我们将要配准的两幅图像分别称为 A 和 B,其中图像 A 是将要进行几何处理以尽可能准确地与图像 B 匹配的图像。然后,CTF 可以用以下方程表示:
- 和
- 其中
- f 和 g 定义了水平和垂直图像维度的变换;
- (u,v) 是图像 A 中的空间坐标;以及
- (x,y) 是图像 B 中的空间坐标。
- 第一步计算是在 (x,y) 坐标系中生成一个最初为空的图像 C,并用从将 CTF 应用于图像 A 中获得的像素值填充它。我们可以说,得到的图像是在图像 B 上配准的图像 A 的版本。
- 当然,问题是如何确定 CTF。对于需要简单几何平移和旋转 x 和 y 维度的场景,函数 f 和 g 可以涉及相对简单的双线性插值。这种变换也可以补偿图像放大率的影响,由此产生的过程称为刚性变换。当遇到空间不均匀性时,可以使用非刚性变换在 x 和 y 维度中应用不同的放大率,以及其他几何平移 - 在这种情况下,可以应用更高阶的插值器。

- 需要确定 CTF 的参数,我们可以使用多种方法,例如:
- 地标- 在两幅图像中都可以识别出突出解剖特征的对应位置,并可以以此为基础推导出两组坐标来定义 CTF。请注意,可以在图像采集期间使用外部标记来创建人工地标,例如,可以在图像采集期间安装一组既是放射性的又是射线不透明的标记。
- 函数最小化/最大化 - 在迭代方式下,将各种几何变换应用于图像以搜索一组参数,这些参数将使该指标最小化(或最大化),同时监控注册质量指标。 统计学基础的计算,例如互信息(MI)最大化可用于此目的。 一个主要优点是,这种类型的图像配准可以在没有操作员输入的情况下自动实现。 通常遵循迭代过程,其中最初为两个图像的低分辨率版本最大化 MI 指标,然后逐步为越来越高的分辨率最大化。 但是请注意,降低射线照片的分辨率会显着影响其空间质量,并且虽然配准可以在此较低分辨率下进行,但生成的 CTF 可以使用适当的放大倍数来将骨骼扫描与全分辨率射线照片配准 - 如图 7.20 所示。
- 一旦图像完成配准,就需要一种方法来组合图像数据以形成融合显示。 一种简单的方法是添加两个图像。 也可以将它们相乘。 但是,当核医学数据中存在热点时,这种形式的图像融合往往会掩盖潜在的解剖结构。 一种更有效的方法是使用一种称为Alpha 混合的图像合成技术,该技术使用透明度值 α 来确定两个图像的比例混合,如图 7.21 所示。

- 这种方法在出版行业得到了高度发展,并且提供了各种融合选项。 一种常用的方法(用于上面的图像)是应用以下形式的方程式:
- 例如,使用 0.5 的透明度值生成图 7.21 左侧面板中的图像,从而可以从热点中辨别出潜在的解剖结构。 这种方法的一个强大的功能是,可以交互地改变融合透明度,以优化数据呈现,例如,或确认配准过程的质量。
- 这种混合方法可以扩展到包含可变不透明度函数,其中将不同的透明度值应用于一个图像的灰度级的不同部分。 请注意,在这种情况下,透明度和不透明度具有互惠关系。 下图显示了示例混合。
- 例如,高-低-高不透明度函数将高水平的不透明度应用于图像对比度尺度顶端和底端的像素值,并将低不透明度应用于中等像素值。 结果是在热点区域之外提高了融合数据的可视化效果 - 如图 7.21 的右上角面板所示。 低-高-低函数具有相反的效果,并生成可视化相关解剖细节及其周围突出显示区域的功能 - 如图的左下角面板所示。 可以根据要融合的两个图像的性质应用对数、指数和其他不透明度函数。
- ↑ Hamers S, Freyschmidt J & Neitzel U, 2001. 使用大型电子平板探测器进行数字放射成像与胶片屏放射成像:临床骨骼诊断中观察者偏好. Eur Radiol, 11:1753-9.
- ↑ Peer S, Neitzel U, Giacomuzzi SM, Pechlaner S, Künzel KH, Peer R, Gassner E, Steingruber I, Gaber O & Jaschke W, 2002. 直接数字放射成像与存储磷屏放射成像在腕部骨折检测中的应用. Clin Radiol, 57:258-62.
- ↑ Uffmann M, Schaefer-Prokop C, Neitzel U, Weber M, Herold CJ & Prokop M, 2004. 平板探测器与存储磷屏放射成像的骨骼应用:曝光对低对比度细节检测的影响. Radiology, 231:506-14.
- ↑ Hamer OW, Völk M, Zorger N, Borisch I, Büttner R, Feuerbach S & Strotzer M, 2004. 使用碘化铯 - 非晶硅平板探测器进行胸部放射成像的 X 射线光谱优化对比度 - 细节体模研究. Invest Radiol, 39:610-8.
- ↑ Uffmann M, Neitzel U, Prokop M, Kabalan N, Weber M, Herold CJ & Schaefer-Prokop C, 2004. 平板探测器胸部放射成像:管电压对图像质量的影响. Radiology, 235:642-50.
- ↑ Hamer OW, Sirlin CB, Strotzer M, Borisch I, Zorger N, Feuerbach S & Völk M, 2005. 平板探测器胸部放射成像:铜过滤后图像质量和剂量降低. Radiology, 237:691-700.
- ↑ Bacher K, Smeets P, Bonnarens K, De Hauwere A & Verstraete K, Thierens H, 2003. 接受胸部成像的患者的剂量降低:数字非晶硅平板探测器放射成像与传统胶片屏放射成像和基于磷屏的计算机放射成像. Am J Roentgenol, 181:923-9
- ↑ Völk M, Hamer OW, Feuerbach S & Strotzer M, 2004. 使用基于非晶硅和掺铊碘化铯的大面积平板探测器降低骨骼和胸部放射成像的剂量:技术背景、基本图像质量参数和文献回顾. Eur Radiol, 14:827-34.
- ↑ Bacher K, Smeets P, Ver- eecken L, De Hauwere A, Duyck P, De Man R, Verstraete K & Thierens H, 2006. 数字胸部成像的图像质量和辐射剂量:非晶硅和非晶硒平板系统的比较. Am J Roentgenol, 187:630-7.
- ↑ Davies AG, Cowen AR, Kengyelics SM, Moore J & Sivananthan MU, 2007. 平板探测器心脏 X 射线系统是否优于基于图像增强器的系统?比较 X 射线剂量和图像质量的研究. Eur Radiol, 17:1787-94.
- ↑ Stadlbauer A, Salomonowitz E, Radlbauer R, Salomonowitz G & Lomoschitz F, 2010. 当前用于胸部和骨骼诊断的数字放射成像系统的 SWOT(优势、劣势、机会和威胁)分析. 健康经济学与质量管理, 15:199-207.
- ↑ Schaefer-Prokop C, Neitzel U, Venema HW, Uffmann M & Prokop M, 2008. 数字胸部放射成像:现代技术、剂量控制和图像质量控制的更新. Eur Radiol, 18:1818-30.
- ↑ Schaefer-Prokop CM, De Boo DW, Uffmann M & Prokop M, 2009. DR 和 CR:技术的最新进展. Eur J Radiol, 72:194-201.
- ↑ Veldkamp WJ, Kroft LJ & Geleijns J, 2009. 胸部放射成像中的剂量和感知图像质量. Eur J Radiol. 2009 年 11 月;72(2):209-17.
- ↑ McAdams HP, Samei E, Dobbins J 3rd, Tourassi GD & Ravin CE, 2006. 胸部放射成像的最新进展. Radiology. 2006 年 12 月;241(3):663-83.
- ↑ Johns PC & Yaffe MJ, 1987. 正常和肿瘤乳腺组织的 X 射线特征. Phys Med Biol, 32:675-95.
- ↑ Rivetti S, Canossi B, Battista R, Lanconelli N, Vetruccio E, Danielli C, Borasi G & Torricelli P, 2009. 胶片屏系统与双侧读数乳腺专用计算机放射成像系统的物理和临床比较. Acta Radiol, 50:1109-18.
- ↑ Liu X, Shaw CC, Lai CJ, Wang T, 2011. 扫描均衡数字放射成像 (SEDR)、槽扫描数字放射成像和全场数字放射成像系统在胸部体模成像中的散射抑制和低对比度性能比较. Med Phys, 38:23-33.
- ↑ Lazzari B, Belli G, Gori C & Rosselli Del Turco M, 2007. 五种临床数字乳腺成像系统的物理特性. Med Phys. 2007 年 7 月;34(7):2730-43.
- ↑ Reiser I & Sechopoulos I, 2014. 数字乳腺断层扫描的综述. Medical Physics International, 2:57-66.
- ↑ Gennaro G, Toledano A, di Maggio C, Baldan E, Bezzon E, La Grassa M, Pescarini L, Polico I, Proietti A, Toffoli A & Muzzio PC, 2010. 数字乳腺断层扫描与数字乳腺成像:临床性能研究. Eur Radiol, 20:1545-53.
- ↑ Sprawls P, 2019. 乳腺成像的科学和技术发展:持续追求可见性. Medical Physics International, 7:141-66.
- ↑ Gennaro G, Golinelli P, Bellan E, Colombo P, D'Ercole L, Di Nallo A, Gallo L, Giordano C, Meliadò G, Morri B, Nassivera E, Oberhofer N, Origgi D, Paolucci M, Paruccini N, Piergentili M, Rizzi E & Rossi R, 2008. 数字乳腺X线摄影中的自动曝光控制:对比度噪声比与平均腺体剂量. 计算机科学讲义,5116: 711-5.
- ↑ Yaffe MJ & Mainprize JG, 2011. 乳腺X线摄影筛查引起的辐射诱发乳腺癌风险. 放射学,258:98-105.
- ↑ Niklason LT, Sorenson JA & Nelson JA, 1981. 胸部X线摄影中的散射辐射, 医用物理,8:677-681.
- ↑ Siewerdsen JH, Daly MJ, Bakhtiar B, Moseley DJ, Richard S, Keller H & Jaffray DA, 2006. 数字放射学和锥形束CT中X射线散射估计和校正的简单直接方法. 医用物理,33:187-97.
- ↑ Nelson JA, Miller FJ Jr, Kruger RA, Liu PY & Bateman W, 1982. 使用时间带通滤波器的数字减影血管造影:初步临床结果. 放射学,145:309-13.
- ↑ Jurriaans E & Wells IP, 1993. 团块追逐:外周动脉造影的新技术. 临床放射学,48:182-5.
- ↑ Bosanac Z, Miller RJ & Jain M, 1998. 旋转数字减影颈动脉造影:技术和与静态数字减影造影的比较. 临床放射学,53:682-7.
- ↑ Anxionnat R, Bracard S, Macho J, Da Costa E, Vaillant R, Launay L, Trousset Y, Romeas R & Picard L, 1998. 3D血管造影。临床意义。介入神经放射学中的首次应用. 神经放射学杂志,25:251-62.
- ↑ Kalender WA, 2006. X射线计算机断层扫描. 医用物理学,51:R29-43.
- ↑ Kalender WA & Kyriakou Y, 2007. 平板探测器计算机断层扫描(FD-CT). 欧洲放射学,17:2767-79.
- ↑ Kyriakou Y & Kalender WA, 2007. 平板探测器CT的X射线散射数据. 医用物理学,23:3-15.
- ↑ Tang X, Hsieh J, Nilsen RA, Dutta S, Samsonov D & Hagiwara A. 体积CT螺旋扫描中图像重建的三维加权锥束滤波反投影(CB-FBP)算法. 医用物理学,51:855-74.
- ↑ Scarfe WC & Farman AG, 2008. 什么是锥形束CT,它是如何工作的?. 北美牙科临床,52:707-30.
- ↑ König M, 2003. 急性卒中脑灌注CT:现状. 欧洲放射学杂志,45增刊1:S11-22.
- ↑ Adams JE, 2009. 定量计算机断层扫描. 欧洲放射学杂志,71:415-24.
- ↑ Hu H, 1999. 多层螺旋CT:扫描和重建. 医用物理学,26:5-18.
- ↑ Flohr TG, Schaller S, Stierstorfer K, Bruder H, Ohnesorge BM & Schoepf UJ, 2005. 多探测器排CT系统和图像重建技术. 放射学,235:756-73.
- ↑ Schardt P, Deuringer J, Freudenberger J, Hell E, Knüpfer W, Mattern D & Schild M, 2004. 通过引入旋转包络管技术,计算机断层扫描中的新型X射线管性能. 医用物理学,31:2699-706.
- ↑ Bardo DM & Brown P, 2008. 心脏多探测器计算机断层扫描:图像采集和临床应用的基本物理学. 当前心脏病学评论,4:231-43.
- ↑ Halliburton SS, 2009. 多探测器排心脏CT的最新技术进步. 心脏病学临床,27:655-64.
- ↑ Flohr TG, Bruder H, Stierstorfer K, Petersilka M, Schmidt B & McCollough CH, 2008. 双源CT扫描仪的图像重建和图像质量评估. 医用物理学,35:5882-97.
- ↑ Kalender WA & Quick HH, 2011. 医学物理学的最新进展. 欧洲放射学,21:501-4.
- ↑ Kim GR, Hur J, Lee SM, Lee HJ, Hong YJ, Nam JE, Kim HS, Kim YJ, Choi BW, Kim TH & Choe KO, 2011. CT透视引导肺活检与传统CT引导肺活检:一项评估辐射剂量和诊断性能的前瞻性对照研究. 欧洲放射学,21:232-9.
- ↑ Hohl C, Suess C, Wildberger JE, Honnef D, Das M, Mühlenbruch G, Schaller A, Günther RW & Mahnken AH, 2008. CT透视期间的剂量减少:角度束调制的体模研究. 放射学,246:519-25.
- ↑ Hara AK, Paden RG, Silva AC, Kujak JL, Lawder HJ & Pavlicek W, 2009. 用于减少CT体部辐射剂量的迭代重建技术:可行性研究. 美国放射学杂志,193:764-71.
- ↑ Sagara Y, Hara AK, Pavlicek W, Silva AC, Paden RG & Wu Q, 2010. 腹部CT:低剂量CT与自适应统计迭代重建和常规剂量CT与滤波反投影在53例患者中的比较. 美国放射学杂志,195:713-9.
- ↑ Löve A, Olsson ML, Siemund R, Stålhammar F, Björkman-Burtscher IM and Söderberg M, 2013. 脑部CT中的六种迭代重建算法:不同辐射剂量水平下图像质量的体模研究. 英国放射学杂志86:20130388.
- ↑ Stiller W, 2018. 计算机断层扫描中迭代重建方法的基础知识:供应商独立概述. 欧洲放射学杂志109:147-154
- ↑ Fleischmann D & Boas FE, 2011. 计算机断层扫描 - 旧思想和新技术. 欧洲放射学,21:510-7.
- ↑ Karcaaltincaba M & Aktas A, 2010. 用多探测器CT重新审视双能CT:原理和临床应用综述. 诊断介入放射学,doi: 10.4261/1305-3825.DIR.3860-10.0, Epub ahead of print.
- ↑ Boll DT, Patil NA, Paulson EK, Merkle EM, Simmons WN, Pierre SA & Preminger GM, 2009. 双能多探测器CT和先进的后处理技术评估肾结石:改善肾结石成分的表征 - 飞行员研究. 放射学,250:813-20.
- ↑ Remy-Jardin M, Faivre JB, Pontana F, Hachulla AL, Tacelli N, Santangelo T & Remy J, 2010. 双能胸部应用. 北美放射学临床,48:193-205.
- ↑ Goo HW & Goo JM, 2017. 双能CT:医学影像的新视野。. 韩国放射学杂志,18(4):555-569
- ↑ Mettler FA Jr, Huda W, Yoshizumi TT & Mahesh M, 2008. 放射学和诊断核医学中的有效剂量:目录. 放射学,248:254-63.









