核医学/核医学中的 X 射线 CT 的基本物理学
多年来,人们一直认识到在 SPECT 成像中需要进行衰减补偿,但直到最近才在商业系统中应用了有效的技术。正如我们之前在 先前中所见,伽马射线会因其穿过的介质而衰减,通过光电吸收和康普顿散射。因此,在 SPECT 成像中测量的投影包含这种衰减的印记,这会降低其用于断层重建的保真度,如下图所示

可以使用患者特定的衰减图来校正测量的投影。可以使用伽马相机生成患者的透射扫描,使用放射性同位素源——参见下图以了解示例

透射扫描包含患者感兴趣区域的衰减信息,随后将这种衰减模式的图应用于每个 SPECT 投影,然后进行滤波反投影。更强大的方法是使用 X 射线 CT 扫描仪生成衰减图——参见下图。因此,已经生产出许多混合扫描仪,将核医学与 CT 成像结合起来,例如SPECT/CT 和PET/CT——参见下图以了解示例

这些发展带来的额外好处是,拥有足够的计算能力,能够同时将核医学图像和 CT 图像混合在一起,从而生成与患者解剖图像共定位的生理图像——如下图所示——从而提高核医学程序的诊断效用。

混合扫描仪通常有一个单一的患者床,伽马相机旋转架模制在 CT 机组的前部,这样患者可以在 SPECT 收集之前或之后被送入 X 射线束中。一些 CT 机组是低分辨率设计的,生成粗略的单层 CT 图像,这些图像对于 SPECT 衰减校正足够精确,但其本身质量不足以用于诊断目的——见下例。还有一些用于混合扫描的高分辨率 CT 机组,例如能够采集 16 层螺旋扫描,可以与专用 CT 扫描仪的诊断能力直接竞争。

本章概述了 X 射线 CT 扫描从核医学角度来看的物理方面。我们从各种扫描仪设计开始,并将探索与这种成像形式相关的多种计算技术。目的是为理解 X 射线 CT 在核医学中的应用奠定基础。
X 射线束在体内的衰减在传统放射成像中被用来将阴影投射到图像接收器上(如下图所示)。这些阴影图记录了三维物体的二维表示。因此,由于重叠和潜在的解剖结构,很难识别小的病变,由于不均匀的放大效果,会发生图像失真,由于散射对图像数据贡献很大,低对比度的肿块难以辨别。

我们可以认为这种图像中引入了退化,即两个在解剖学上完全不同的物体可能会产生相同的胶片密度,因为它们各自产生的有效衰减是相同的,如下图所示

面板 (a) 显示了入射强度为 Io 的铅笔束 X 射线,被身体衰减,为简单起见,这里用四个体积元素表示,每个体积元素的厚度为 Δx,具有不同的线性衰减系数 μ1 到 μ4。当没有检测到散射辐射时,透射强度由 I 给出,它取决于这些线性衰减系数的总和,根据指数衰减方程。面板 (b) 说明了即使两列相邻的体积元素包含具有不同线性衰减系数的体积元素,它们也能生成相同的透射强度 I 值。换句话说,检测到的是线性衰减系数的综合贡献,而没有关于任何单个体积元素的贡献的信息。
改进这种情况的一种方法是使用 X 射线计算机断层扫描 (CT)。请注意,为 X 射线 CT 开发的图像重建算法也可以应用于伽马相机图像(如SPECT),以克服平面核成像的局限性,以及使用正电子发射放射性同位素生成的图像(如PET)。
我们在前一章中在 SPECT 的背景下讨论了这种计算机图像重建方法。我们在这里的目的是在 X 射线 CT 的背景下讨论这种重建方法。
下图显示了反投影的工作原理。基本前提是假定 X 射线束的任何衰减都是沿整个射线路径均匀发生的。

因此,对第一个轮廓 P1 进行反投影的结果是分别将值 7 和 9 放入第一行和第二行的两个元素中。第二个轮廓 P2 在反投影时向右上角元素添加了 4,向左下角元素添加了 1,向其他两个元素添加了 11。其他轮廓以类似的方式处理。在减去偏移量(在本例中为 16)并对数据集进行重新归一化(在本例中除以 3)之后,将获得最终图像。您应该自己确认此最终矩阵是否满足所有投影。
下图更详细地说明了该原理

单个轮廓被反投影到整个图像平面上,形成一条暗条纹 [面板 (a)]。当我们从多个方向扫描幻影并将射线轮廓反投影到图像平面 [面板 (b)] 时,放射密度点的图像,尽管质量很差,但开始变得清晰 [面板 (c)]。随着投影数量的增加,质量会提高,但图像中始终会保留一些模糊。
这种模糊可以使用称为滤波反投影的方法消除。
可以使用滤波技术在数学上抑制简单反投影过程中固有的模糊,整个重建过程被称为滤波反投影。在这种技术中(参见下图),首先对衰减轮廓进行滤波,以抵消突然的密度变化的影响,这些变化会导致简单反投影中的模糊。请注意,图中的图形表示非常粗略,因为滤波轮廓可能是距离的相当复杂的函数,如面板 (c) 所示。该滤波器也称为卷积滤波器或卷积核。完成滤波过程后,在进行反投影过程之前,对每个轮廓的数据应用逆傅里叶变换。请注意,重建的图像 [面板 (d)] 没有在未滤波的反投影中生成的星形伪影。

大多数CT扫描仪提供多种滤波器供操作人员选择,以增强图像中的软组织特征或骨骼细节。实际上,如果需要,可以在扫描完成后使用不同的滤波器对图像进行后处理。可以生成图像以增强骨骼细节,另一方面观察微妙的低对比度肿块,而无需重新扫描患者。因此,滤波器选择将对图像质量产生重大影响。X射线CT中常用的两种滤波器是Ramachandran & Lakshminarayanan (Ram-Lak)和Shepp & Logan滤波器。在SPECT中,使用Butterworth、Hanning和Metz滤波器,正如您所记得的那样。单独的斜坡滤波器可以补偿简单反投影过程引入的伪影,但不能补偿数据随着空间频率增加而增加的噪声含量。Ram-Lak是一个斜坡滤波器,它使所有频率保持不变,除了截止频率以上的频率,这些频率被消除。大多数其他滤波器在不同程度上抑制较高频率。有时这些滤波器被称为算法。术语内核也被使用。下面显示了用软组织算法和骨骼算法重建的轴向断层图像作为示例

在EPFL的生物医学成像组提供了一个非常好的在线CT重建模拟器。作为练习,您可能希望通过改变重建前使用的滤波器类型来探索您对滤波反投影的理解。您可能还想探索用于轮廓获取的角度数量对重建图像质量的影响。

大多数CT扫描仪设计使用某种形式的机械旋转架,该旋转架允许X射线管和探测器围绕患者移动。在早期设计中,X射线束被准直成铅笔束,在现代系统中则由宽扇形束组成。切片的厚度,通常为1到10 mm,通常由X射线管外部的电机驱动的可调节楔形体进行患者前准直定义。即使使用相对较大的扇形束,照射的组织体积与投影射线照相相比仍然很小,散射问题不那么严重。探测器前面有准直器,以最大程度地减少切片外散射的影响。为了最大程度地减少束硬化的影响,CT扫描仪使用重滤波束(例如,西门子Somatom Plus使用2.7 mm Al加0.2 mm Cu),工作在120 – 140 kVp。请注意,即使在最佳射线照相几何形状下,例如在第三代扫描仪中,物体放大率也很大,典型为1 mm的焦点尺寸很可能限制了可实现的空间分辨率。
第一代CT扫描仪使用的是所谓的平移-旋转几何形状。例如,最初的EMI Mk 1扫描仪(参见右侧的图)使用铅笔状X射线束和单个探测器(一个与光电倍增管耦合的NaI:Tl闪烁体)。在旋转架的平移运动过程中,透射的X射线束被采样160次以产生单个轮廓。然后在X射线束关闭的情况下旋转1度,然后再获得新的轮廓。重复此过程,直到对患者头部进行180个不同角度的扫描。

整个过程大约需要5分钟,并取决于患者完全保持静止。患者头部通常被夹住以最大程度地减少患者运动。此外,他们的头部被一个水袋包围,这有助于克服与NaI(Tl)闪烁体余辉和探测器中本来存在的非常大的信号动态范围相关的問題。后来的扫描仪试图将扫描时间缩短到几秒钟,以最大限度地减少运动伪影。
第二代扫描仪通过使用带有多个探测器的小扇形束(参见下一图)来解决这个问题,在某些设计中,最多可达30个探测器。探测器在平移过程中收集多个数据读数,因此需要更少的平移和旋转。每个探测器在每次平移过程中收集自己的有限轮廓。通常,在平移运动之间采用30度的旋转,因此只需要六次旋转运动就能获得一个切片的数据。
这种设计实现了5到90秒的扫描时间。探测器元件是闪烁体,但取消了水袋,并且第一次可以进行人体扫描。使用多个探测器使性能有了质的飞跃。
第三代CT扫描仪通过使用旋转-旋转几何形状(参见右侧的图)进一步缩短了扫描时间。如今大多数扫描仪都是第三代类型。典型的机器使用一个大的扇形束,以使患者完全被扇形束包围。探测器元件的数量通常在数百个,例如
- GE Hispeed Advantage有852个元件,相隔1.0 mm;
- 西门子Somatom Plus 4有768个元件,相隔1.1 mm;以及
- 东芝Xpress/SX有896个元件,相隔1.03 mm。

探测器元件沿以X射线管焦点为中心的圆弧排列。X射线管和探测器阵列作为一个整体旋转360度,在此期间获得数百个离散轮廓。固态探测器和加压氙气探测器都被用于数据采集。
由于扇形束完全包围患者,因此不需要平移运动,并且管和探测器阵列作为一个整体围绕患者旋转。记录的轮廓数量取决于所选的扫描参数,但至少有几百个,甚至可能超过一千个。扫描时间可以低至一秒。虽然探测器的动态范围非常高,但一些制造商通过使用适合人体或头部形状的领结形滤波器来控制信号强度过大的变化。此类滤波器通常比中心部分在更大程度上衰减扇形束的外围部分。它还有助于克服束硬化的影响,并最大限度地减少视野外围部分患者的皮肤剂量。
针对这种几何形状,已经开发出许多变体,包括基于偏移旋转中心和使用飞行焦点X射线管的变体。

第四代CT扫描仪使用旋转-固定环几何形状,其中一个固定探测器环完全包围患者。X射线管在探测器环内旋转360度,并具有宽扇形束。只有看到光束的探测器才会被激活,这意味着在任何给定时间,只有几千个探测器元件(例如,Picker PQ-5000V有4800个探测器元件,相隔1.1 mm)在使用。扫描时间与第三代扫描仪相当,但射线照相几何形状较差,因为X射线管必须比探测器更靠近患者,即几何放大率很大。
上述几何形状差的缺点通过所谓的摆动几何形状得到了很好的解决。X射线管位于探测器环的外部,但略微偏离探测器平面。使用这种类型的机器,可以实现低至0.6秒的扫描时间,扫描间延迟低至100毫秒。通过使用数千个探测器元件,可以获得优异的分辨率(0.35 mm)。
滑环技术方面的创新,从西门子Somatom Plus和东芝TCT 900S开始,使X射线管能够朝着同一方向连续旋转,从而克服了扫描间延迟的问题。当X射线管的连续运动与患者床沿扫描仪轴线连续移动相结合时,我们得到了螺旋(也称为螺旋)扫描,如图所示。典型的床速为1 – 10 mm/s;可以在0.5秒内完成完整的360度旋转,名义扇形束厚度为1 mm或更大。

在螺旋扫描的背景下,一个称为螺距的参数被定义为
换句话说,对于10 mm的床移动量和10 mm的名义切片宽度,螺距为1。螺距值通常在1到2之间,具体取决于床运动方向所需的空間分辨率。它是覆盖范围指标,换句话说。
螺旋扫描可以显著减少扫描时间,因为可以连续扫描大体积,没有任何间隙,并且受患者运动的影响很小。例如,Somatom Plus-4A允许在60秒的无间断扫描中连续扫描多达80个切片。因此,可以进行胸部的单次屏气扫描,并且可以重建矢状面和冠状面,而空间分辨率损失很小。
螺旋扫描中的轴向重建如图所示。可以看出,在扫描过程中实际上没有照射任何轴向切片,并且任何横轴图像数据都需要从获取的螺旋记录中估算。一种估计技术称为z插值,因为它沿获取数据的z维,即患者的头脚轴,应用数据插值技术。

因此,滤波反投影重建过程被修改为在傅立叶滤波之前包含一个z插值步骤,如图所示流程图

在继续之前,让我们简要回顾一下插值和外推的主题,以澄清我们的基本理解并将后续讨论置于上下文中。让我们从一个简单的单维情况开始,如图所示。假设我们已经对A和B进行了测量,并将它们绘制在图上,并希望估计中间点C的值。这种估计过程称为插值,如果我们假设变量X和Y之间存在线性关系,如图所示,则估计点C的过程称为线性插值。对于比我们这里考虑的更复杂的数据,还可以使用其他函数作为插值函数。

如果我们还需要了解图上点 D 的信息,即测量范围之外的点,我们就称之为外推法,线性外推法在上面的图中已经说明。
在数学上,我们可以写成,给定
那么点 C 的 Y 值由下式给出
使用线性插值。您不妨试着推导出一个类似的公式,用于确定点 D 的 Y 值。
由于螺旋扫描是一种三维现象,我们需要在继续讨论之前对这种情况进行一些二维视角的分析,如下图所示。

在下文中,我们将使用侧面视图。
螺旋 CT 中的插值
[edit | edit source]已经开发出许多用于螺旋扫描的计算方法。360o线性插值算法以以下图形为例进行说明。

基于我们之前关于线性插值的目标横断数据讨论,可以推导出以下公式
其中
- Pz(i, α) 是在方位 Zref 上,角度为 α 的插值投影;
- Pj(i, α) 是在第 j 次旋转时,方位 Zj 和投影角度 α 处测量的螺旋投影;
- Pj+1(i, α) 是在第 j+1 次旋转时,方位 Zj+1 和投影角度 α 处测量的螺旋投影;以及
这个插值过程应用于螺旋中的所有数据点,以生成对轴向数据的估计,然后进行滤波反投影。也可以进行更高阶的插值,例如使用来自四条射线的点进行估计。此外,在多层螺旋 CT 中,可以对这些估计应用复杂的 z 轴滤波器。
体积成像
[edit | edit source]当 CT 扫描仪的扇形束沿着 z 轴扩展并使用二维探测器时,可以产生每旋转一次多个切片。在此基础上,扇形束可以形成锥形,并应用体积成像和锥束 CT等概念。在这个背景下,还可以使用多层和多探测器 CT 等术语,尽管您会发现这两个术语中的第二个可能是更合适的。
二维探测器是固态器件,最简单的例子是矩阵阵列,如下图所示。

该阵列可以由(例如)912 列 x 16 行的相同探测器组成,每个探测器为 1.25 毫米见方,弯曲以适合 X 射线管旋转的弧线。上图(a)中显示了其中 8 列被 6 毫米宽的 X 射线束照射,这意味着可以同时采集 4 个 1.25 毫米轴向切片的数据。当 X 射线束扩展到覆盖探测器阵列的宽度时,这种排列可以同时照射更多的行,在这种情况下最多可达十六行。
通过耦合相邻探测器行的输出,可以在此设计中实现灵活性,如(b)、(c)和(d)中的面板所示,其中分别将 2 行、3 行和 4 行的输出相加,从而同时生成 4 个 2.5 毫米厚的切片,或 4 个 3.75 毫米的切片,或(您猜对了!) 4 个 5 毫米的切片。
自适应阵列探测器提供了一种更灵活的设计,如下图所示。

与方形探测器列不同,该阵列使用宽度可变的探测器列,因此两个中心列的宽度相对较窄,例如上图中的 1 毫米,列宽度向外围增加,例如从 1.5 毫米,通过 2.5 毫米到 5 毫米,如我们的图所示。这种模式的原因将在下面解释。
以下图示显示了该探测器阵列的四种工作模式。

我们可以在(a)中看到,当 1 毫米厚的扇形束与自适应阵列的中心列对齐时,可以采集两个 0.5 毫米的切片。在(b)中,我们看到可以使用 4 毫米厚的扇形束来采集四个 1 毫米的切片。探测器耦合在(c)和(d)中得到说明,其中将四个中心列中探测器的输出耦合,以便模拟两个 2.5 毫米宽的检测列,因此可以采集四个 2.5 毫米的切片数据。您认为这种耦合过程是如何在(d)中应用以生成四个 5 毫米的切片?
自适应阵列的第二个优势是,每行单个探测器元件的数量可以大大减少,在我们刚刚讨论的例子中,从 16 个减少到 8 个。这极大地提高了阵列生成数据的速度,并减少了必须对测量数据进行均匀性和其他校正所需的计算量。
多层螺旋 CT 中的插值过程在我们最后的图中得到说明,其中显示了使用360o多层滤波插值算法的 4 层系统的情况。

2010 年,多探测器 CT (MDCT) 中的探测器行数通常为 8 行、16 行或 64 行,甚至更多,甚至已经开发出 320 层的扫描仪。
CT 图像显示
[edit | edit source]在计算机通过滤波反投影计算出每个像素的线性衰减系数后,这些值会以水为参考进行归一化,然后进行缩放并以豪斯菲尔德单位或 CT 值的形式呈现,定义如下。
其中 μm 和 μwater 分别代表组织材料和水的线性衰减系数。因此,水的 CT 值为零。下表列出了多种组织的 CT 值:
| 组织 | CT 值 (H) |
|---|---|
| 肺 | -300 |
| 脂肪 | -90 |
| 白质 | 30 |
| 灰质 | 40 |
| 肌肉 | 50 |
| 松质骨 | 300-500 |
| 皮质骨 | 600-3,000 |
图像通常使用灰度级在计算机显示器上呈现。通过选择合适的窗口级别和窗口宽度,可以显示所有或部分 CT 值范围。窗口宽度是指用于显示的 CT 值范围,窗口级别通常(但并非总是)是指选择窗口的中心 CT 值。通常,最高数值被分配为白色,最低数值被分配为黑色,所有中间数值都被分配为线性尺度上的强度。因此,空气将显示为黑色,而皮质骨将显示为相对明亮。
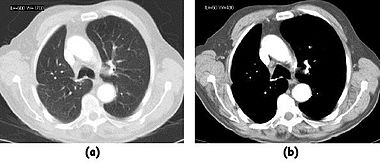
以下两幅图展示了图像显示操作的示例。在第一幅图中,同一患者肝脏切片的图像使用相对较窄的窗口(高对比度)和较宽的窗口进行显示。使用较窄窗口的图像看起来更嘈杂,但这仅仅反映了灰度级在较窄的 CT 值范围内扩展这一事实。

在第二幅图中,使用相对较窄的窗口来突出病变。
扫描投影放射成像
[edit | edit source]大多数 CT 系统使用扫描投影放射成像 (SPR),也称为扫描视图和扫描图,来建立所有后续程序的一致解剖标记集。在 SPR 中,扇形束不围绕患者旋转,而是固定,患者床缓慢地穿过束。当解剖结构在焦点和探测器之间变化时,每个探测器元件测量不同的辐射强度。这些离散探测器信号被数字化,但没有经过任何重大处理。计算机将来自所有探测器的信号存储为一系列线图像。每条线的宽度很小,通常为 1.5-2 毫米,对应于扇形束的有限宽度。随后,通过将这些线扫描图像进行合成,并选择合适的灰度级来以足够的对比度显示解剖结构,从而合成投影放射图像 - 请参阅以下示例图像。

一旦 SPR 图像生成,就可以定义要在 CT 模式下检查的组织体积。然后,一旦选择合适的扫描参数,CT 程序就可以由计算机自动控制。





