生物化学/蛋白质/蛋白质的化学
氨基酸由一个连接到脂肪族碳原子(称为α-碳)的伯胺组成,该碳原子反过来又连接到一个羧酸基团。至少一个氢原子与α-碳连接;此外,α-碳带有一个侧链,不同氨基酸的侧链不同。在中性水溶液中,氨基酸以两种形式存在。极少一部分氨基酸分子将呈中性,具有去质子化的氨基和质子化的羧酸基团。然而,绝大多数分子将处于两性离子 互变异构体,在(质子化的)氨基上带正电荷,在(去质子化的)羧酸根上带负电荷。
氨基酸通过肽键连接。(从有机化学的角度来看,肽键是一种类型的酰胺基团。)肽键由一个羰基的碳原子直接连接到一个仲胺的氮原子组成。肽链在一端将有一个未结合的氨基(称为N端)和另一端有一个游离的羧酸基团(称为C端)。
肽键是平面的,因为羰基和氨基氮之间的共振使C-N键具有部分双键特性。(可以画出一个带有碳原子和氮原子之间双键的共振结构,氧原子上有正式负电荷,氮原子上有正式正电荷。)这阻止了C-N键周围的旋转,将肽键锁定在反式构象中,并将六个原子固定在平面上:一个氨基酸的α-碳、羰基碳和氧原子、氨基氮和氢原子以及第二个氨基酸的α-碳都是共面的。
肽链“骨架”的结构可以通过相邻肽单元之间的扭转角来唯一地描述。 φ角是相邻氨基酸的α-碳与羰基碳之间的扭转角;ψ角是氨基氮与α-碳之间的扭转角。
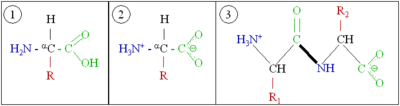
当一个氨基酸的氨基端(红色)与另一个氨基酸的羧基端(蓝色)连接时,两个具有不同侧链的氨基酸发生反应,通过酰胺键(绿色)连接。另请参阅肽键形成的机制。
重要的是要注意,在标准条件下,这种肽键的形成是非常不利的。然而,在人体中,存在一些酶可以帮助促进这种反应,使肽键形成和蛋白质成为可能。
由遗传密码编码的20种氨基酸是

为了清晰起见,它们没有显示在两性离子状态下。在生理 pH(约 pH 6.8)下,所有氨基酸都将呈两性离子状态,除了脯氨酸,它是一个五元环。带电侧链在生理 pH 下以离子形式存在时将显示为离子形式。
蛋白质电泳是一种方法,通过该方法可以分离和分析蛋白质混合物。电泳基于离子在电场中的迁移率。分子的电荷分布是所有电泳分离的关键。在电场中,电泳是带电分子在溶液中的通过。带正电的离子倾向于向负极迁移,反之,带负电的离子倾向于向正极迁移。分子量会导致分子摩擦,分子摩擦与分子电荷和电压成正比,与分子在电场中的迁移率成反比。
凝胶电泳用于分析蛋白质的分子量和电荷,主要用于蛋白质电泳。凝胶电泳在一片薄薄的聚丙烯酰胺中进行。丙烯酰胺和 N,N'-亚甲基双丙烯酰胺通过聚合形成交联的聚丙烯酰胺。尺寸对蛋白质分子运动有重要影响。较小的蛋白质分子将导致分子更快地通过凝胶孔隙。
蛋白质分子在凝胶中的分离会影响蛋白质活性。在这个过程中,首先通过加热使蛋白质减少二硫键的破坏,从而导致蛋白质的纯化和变性。接下来,添加十二烷基硫酸钠(简称为 SDS)(和离子去垢剂)。SDS 是一种阴离子去垢剂,它可以溶解疏水分子并使蛋白质分子变性而不破坏肽键。这会导致蛋白质结构的错位,将二级、三级和四级结构改变为带负电荷的一级结构。然后蛋白质通过凝胶。对于变性蛋白质,SDS 可以通过与蛋白质结合形成稳定的电荷-质量比。
聚丙烯酰胺凝胶电泳是一种非常灵敏的方法,能够承受高分辨率,它在分离技术研究中得到分析应用。
等电点(pI)是蛋白质呈中性(即净电荷为零)的 pH 值。需要明确的是,它不是蛋白质所有碱都被去质子化且所有酸都被质子化的 pH 值,而是正负电荷抵消为零的 pH 值。
计算 pI:具有 n 个可电离基团(其相应的 pKa 值分别为 pK1、pK2、... pkn)的氨基酸的 pI 等于这些基团 pKa 的平均值。
pI=(pK1+pK2+...+pkn)/n
大多数蛋白质除了它们的氨基和羧基末端基团外,还有许多可电离的侧链。每种蛋白质的 pI 都不相同,如果我们知道蛋白质的氨基酸组成,则可以根据亨德森-哈塞尔巴尔赫方程理论计算 pI。
为了实验确定蛋白质的 pI,可以使用二维电泳 (2-DE)。将细胞裂解液中的蛋白质应用于 pH 固定的梯度条,在电泳后,蛋白质迁移到条带内的 pI。2-DE 的第二维是使用 SDS-凝胶根据 MW 分离蛋白质。为了清楚地理解等电点,你必须记住,带正电的基团通过带负电的基团来平衡。对于简单的氨基酸“丙氨酸”,等电点是羧基的 PKa(PK1 为 2.34)和铵的 PKa(PK2 为 9.69)的平均值。因此,简单氨基酸“丙氨酸”的 PI 计算为:(2.34+9.69)/2,等于 6.02。当添加额外的碱性或酸性基团作为侧链功能时,等电点 pI 将是最相似酸的 pKa 的平均值。这种概念的例子可以是天冬氨酸,其中相似的酸是 pKa 为 2.1 的 α-羧基功能和 pKa 为 3.9 的侧链羧基功能。因此,天冬氨酸的 pI 为 (2.1+3.9)/2=3.0。另一个例子是精氨酸,其相似的酸是侧链上的胍基,pKa 为 12.5,以及 α-铵功能,pKa 为 9.0。因此,精氨酸的计算 pI= (12.5+9.0)/2=10.75。pI 没有单位。
两个氨基酸分子可以通过一个被称为**肽键**的取代酰胺键共价连接,形成一个二肽。该键的形成是通过脱水反应实现的(移除水分子 - 一个氨基酸的一个氢原子和另一个氨基酸的一个羟基)。这个过程可以继续连接其他氨基酸,形成一条氨基酸链。当链中只有少量氨基酸时,称为**寡肽**;当有大量氨基酸时,称为**多肽**。虽然“蛋白质”和“多肽”这两个词有时用来描述同一事物,但当链的分子量低于10,000时,一般使用“多肽”这个词。肽中的一个氨基酸单元通常被称为**残基**。
二硫键
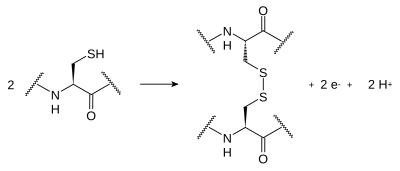
[edit | edit source]二硫键在蛋白质中两个半胱氨酸侧链的硫原子之间形成。侧链经历半胱氨酸巯基的可逆氧化,导致硫原子(S-S)的共价键合。这种键合被称为“二硫桥”。通常,由于细胞质中存在还原剂,二硫键不会在蛋白质表面形成。这些键对蛋白质结构的形成非常重要;它们的形成指导肽链在蛋白质合成过程中的折叠。必须具有严格稳定性的结构蛋白(例如,在指甲、角和甲壳类动物外壳中发现的角蛋白)通常含有大量的二硫键。
翻译后修饰
[edit | edit source]蛋白质在细胞内合成后,通常会通过在多肽链上添加额外的功能基团进行修饰。这些可以是糖基或磷酸基团,它们可能赋予蛋白质特殊功能,例如:识别其他分子、整合到质膜中、催化生化反应以及各种其他过程。生物化学家需要了解哪些蛋白质被修饰、修饰是什么以及修饰在何处。一个简单的实现方法是使用质谱法。在一个提交到质谱法的蛋白质样本中,你会看到修饰和未修饰的蛋白质信号。这些信号之间的质量变化将对应于蛋白质由于翻译后修饰而发生的质量变化。
