生态学/生物群落
第 4 章。生物群落
一个群落 或 生物群落 是一个生物体(物种种群)的集合,其组成和外貌由环境的特性以及生物体之间的关系决定(修改自 Braatne,2005 年)。Möbius 在 1877 年的北海牡蛎礁研究中提出了生物群落这一术语,他认识到,在一个结构复杂的系统中,物种之间的相互作用带来了更高水平的功能复杂性。Shelford 将群落定义为“具有分类组成统一性和相对一致的外观(Odum,1959)的集合”。生物群落,以及环境的物理或非生物因素共同构成生态系统 - Tansley(1935)中的群落生物体如何与其环境相互作用。
像“生态系统”一样,群落所占据的大小或面积可以有很大的不同。由组成物种种群的分布范围重叠的地方界定,群落产生均匀的物种组成。某些物种也可能是其他周围(或远距离)群落的成员。就像在第 5 章中讨论的生态系统概念一样,群落概念被广泛定义为嵌套单位之一:概念上较小的单位可能属于更大的包含单位的一部分。当生态学家将主要群落定义为具有足够大小和组织完整性,以至于相对独立于邻近群落的群落,而将次要群落定义为或多或少依赖于邻近(或周围)群落的群落时,就认识到了这一点。
群落表现出功能和结构(分类)上的统一性,尽管某些物种可能随着时间和空间而被替代,因此功能上相似的群落可能具有不同的物种组成。群落概念强调了生物体以有序的方式共同生活的想法;物种分布不仅仅是单个个体以类似的方式对特定的一组物理因素作出反应。当然,群落具有超出其物种种群和独特属性的总和的特性或特征。
- 阅读生物群落

简而言之,群落是指在同一时间同一地点生活在一起的种群集合,它们相互作用并与周围环境相互作用。根据这个定义,在描述不同类型的群落时,也认识到了各种空间尺度。空间尺度指的是构成群落的生物体的大小,可以从非常小(即细菌)到非常大(即动物)不等。空间生态学有三种方法:理论生态学、种群生态学和景观生态学(Hanski 1998)。每个群落都会影响另一个相邻的群落,即群落之间不断地相互渗透。阅读种群。
群落中不同空间尺度的示例
- 1. 森林 - 由树木、植物和动物组成
- 2. 一棵树 - 由昆虫和植物的群落组成
- 3. 白蚁肠道 - 由原生动物、细菌和古细菌的群落组成
- 阅读群落(生态学)。
群落的涌现属性包括稳定性、对入侵和干旱的反应和复原力,以及生物修复。(阅读生物修复)
地球包含许多不同的地理区域,这些区域具有相似的气候条件。由于自然选择,许多类似的生态系统,“生物群落”,在这些区域发展起来。生物群落是指全球范围内的群落,通常由温度、降水量以及居住其中的植物和动物类型来定义。一般来说,生物群落分类是由一个地区的氣候和地理位置决定的。每个生物群落都由适应了生物群落内部不同气候和环境的群落组成。具体来说,为了适应环境,植物已经发展出了特殊的适应性,动物也已经发展出了物理和行为上的适应性。

已经确定了几个生物群落,包括热带森林、温带森林、针叶林、草原、灌木丛、沙漠、苔原和水生环境。热带森林的特点是降水量高(每年约 75-200 厘米降雨量)和气温高。相比之下,针叶林的针叶林每年仅获得 30-84 厘米的降雨量,冬季平均气温为 -60 摄氏度。灌木丛也拥有极端的气温和低降水量(每年 15-40 厘米),而草原平均每年降雨量为 25-70 厘米,气温与温带森林和沙漠相似。沙漠和苔原都是非常干旱的生物群落(每年降水量少于 30 厘米),但在平均气温范围方面差异很大。虽然地球上显然有各种各样的生物群落,但它们在陆地面积方面的分布并不均衡。

针叶林是覆盖地球表面的最大陆地生物群落。它们位于北半球,就在苔原下方,覆盖了北半球 11% 的陆地面积,占地球总森林面积的 27%。事实上,世界上最大的森林就是西伯利亚针叶林。
构成针叶林的针叶树表现出针叶而不是树叶,这是对针叶林生物群落的特殊适应。针叶的表面积较小,可以更好地保持水分,并且具有蜡质覆盖和凹陷的气孔,有助于减少水分流失并保护针叶树免受冰冻天气。针叶树深绿色的颜色有助于吸收来自太阳的能量,以诱导光合作用,从而生存。针叶树还具有倒置的漏斗形状,有助于清除大量的积雪负荷。漫长的寒冷冬季和短暂的夏季使得植物和动物难以生存,因此针叶林生物群落的生物多样性低于其他生物群落。针叶林地区的酸性土壤也会影响植被以及以这些植物为食的动物。
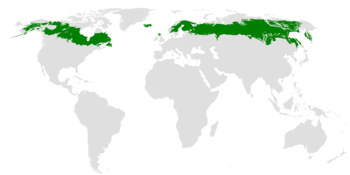
针叶林的生存和陆地面积覆盖率受到许多因素的威胁。由于针叶树的木质树皮很容易燃烧,因此火灾(自然或人为)对针叶林构成了重大威胁。此外,伐木和开垦牧场也减少了某些地区的针叶林面积。马尼托巴省已经将 40% 的生产性针叶林用于砍伐;该区域面积相当于北达科他州。此外,加拿大阿尔伯塔省将在未来六十年内允许大规模的森林砍伐。针叶林的大量消失是一个重大问题,不仅因为它会导致生物多样性和氧气产量的损失,还会导致“温室效应”。草原也受到干扰的影响。Belcher 等人 1989 年[1] 研究了加拿大马尼托巴省 25 平方公里的混合草草原。研究表明,原生草原受到道路、小径和耕种防火带等干扰的影响。这些干扰使矿物土壤暴露,从而导致乳浆大戟侵染,这使得占优势的原生草种的丰度显著下降。乳浆大戟对潜在的牧场构成威胁,并且会影响原生植被的保护。
自然界存在三种类型的水生群落:海洋、淡水和河口。
海洋生物群落依靠盐度相对较高的水体生存,由能够在高盐环境中生存的生物组成。热带珊瑚礁就是一个例子,它通常存在于纬度范围为北纬30°到南纬30°的浅水热带海域。平均而言,这些生物群落的生长仅限于深度不到100英尺、水温高于72 °F (22 °C) 的区域。这些生长限制因素促进了石灰石的形成,而石灰石是珊瑚礁的主要结构成分。石灰石是由活生物分泌的,包括刺胞动物、珊瑚藻、软体动物、棘皮动物和一些环节动物。刺胞动物是石灰石形成的主要贡献者,因为它们分泌了碳酸钙的外骨骼。[2]

珊瑚礁主要分为三种类型:边缘礁、堡礁和环礁。边缘礁与海岸线相连,通常在退潮时暴露出来。堡礁距离海岸较远,通常与海岸之间隔着泻湖,泻湖中可能会有岛屿。大堡礁位于澳大利亚海岸外,是世界上已知的最大的珊瑚礁。它的宽度在120英里的长度上从10英里到90英里不等。环礁是一种允许海水流出并环绕着一个没有岛屿的泻湖的礁石类型。
珊瑚礁为行动和非行动物种的生物提供栖息地。龙虾、螃蟹、鱿鱼、礁鲨以及各种鱼类和海参都以珊瑚礁为食。不同类型的藻类也栖息在珊瑚礁上,并为捕食者提供食物来源。
虽然珊瑚礁是一个重要的海洋生物群落,但许多因素正在对其生存产生负面影响。事实上,正如杰克逊 (1997) 指出,珊瑚礁群落在生态学研究于 1920 年代被认为与我们生活息息相关之前就已经退化。 ^ 如今,与捕鱼业相关的船舶船体和锚正在对珊瑚礁造成破坏,而珠宝业的高需求正在大幅减少珊瑚礁的规模。沿海开发、水污染和旅游业也对珊瑚礁群落的成功构成威胁。杰克逊提出,如果要对珊瑚礁进行保护,需要进行大规模的珊瑚礁保护工作,这将带来“极端”的政治、经济和社会影响。 ^
[3] [http://www.reefbase.org/key_topics/reeffisheries.as}

与海洋生物群落形成对比的是,淡水生物群落依靠盐度相对较低的水体生存,由很可能无法在高盐环境中生存的生物组成。淡水生物群落包括河流、湖泊、溪流和池塘。
一个河口代表了一种由淡水和盐水共同支撑的生物群落。河口位于沿海地区,与海洋有开放的连接,并具有一定的淡水流入 (例如,河流和溪流)。因此,它们会受到两种环境限制的影响,从而形成了许多小的生物生态位,并容纳了高度的多样性。

由于河口水体盐度变化无常,在进行河口分类时必须考虑许多因素。循环模式、潮汐范围、淡水输入、主要栖息地类型等都是河口变化的潜在因素。因此,河口通常按区域 (例如,美国东北部、美国东南部) 进行分类。然而,正如罗曼等人指出的那样,由于特定区域的地貌复杂性,每个河口都可能表现出独特的特征。 ^ 尽管区域分类通常是可以接受的,但重要的是要记住,总有例外。
水生生态系统
[edit | edit source]水生生态系统 主要分为两种类型:淡水生态系统 和 海洋生态系统。这些生态系统中生命的驱动力量主要是植物的生长,食物链由此开始。植物生长需要四个要素。分别是水、太阳辐射形式的能量 (阳光)、无机碳 (二氧化碳或碳酸氢根离子) 以及矿物质/营养物质。我们可能认为理所当然的一件事是,许多生态系统都位于人类的下游。然而,生态系统并没有忽视这一事实。弗里塞尔指出,许多经过良好监测的物种因位于人类下游而受到不利影响。弗里塞尔认为,这是因为我们需要以不同于陆地生态系统的方式看待对水生生态系统的影响。火灾和风暴等事件对陆地生态系统产生了巨大影响,而对水生系统的影响却很小。与此同时,洪水和加速侵蚀等事件对陆地生态系统的限制较小,但在水生生态系统中却非常重要。这正是看待水生生态系统的背景。 [4]
淡水生态系统
[edit | edit source]对淡水生态系统的研究被称为湖沼学。它可以细分为两个主要类别:静水生态系统,它位于盆地中;流水生态系统,它是由流动的水体构成的。冰川是静水环境的一个原因,退缩的冰川留下了盆地。流水生态系统中的流水产生了大约 6 到 30 倍的初级生产者 的生产力,相比于静水中初级生产者的生产力 (Nelson and Scott 1962)。
海水生态系统
[edit | edit source]海水生态系统的结构由温度、盐度、洋流、波浪和潮汐决定。海洋中生产力最高的区域是珊瑚礁和沿海水域。淡水河流最终会流入海洋,陆地生态系统与海洋边缘相遇。在某些地区,特别是澳大利亚,淡水区域的盐度有所上升。这已被证明是该地区自然选择的驱动因素;只有耐受力最强的生物才能生存并繁殖。不幸的是,这些地区的盐度似乎还会继续升高。然而,盐度变化对生态系统的影响尚不清楚,这些地区还需要进一步观察。 [5]
湖沼学
[edit | edit source]湖沼学 (源自希腊语: Λίμνη limne,"湖泊";和 λόγος,logos,"知识") 是对内陆水体 (淡水和咸水) 以及其生物、物理、化学、地质和水文方面的研究。这包括对天然和人工湖泊、池塘、河流、溪流、湿地和地下水的研究。在研究生态系统的动力学时,湖沼学涉及水体的 pH 值、温度、深度和溶解氧剖面等变量。使用塞奇盘透明度测试或分析物种多样性和丰度来测试系统的生产力。
弗朗索瓦-阿尔фон斯-福雷尔 (1841-1912) 通过对日内瓦湖 (欧洲最大的淡水湖) 的研究建立了这一领域。湖沼学与水生生物学密切相关,水生生物学是研究水下生物的科学,它将物理学、化学、地质学和地理学原理和方法应用于生态问题。现代水生生物学的大部分内容可以看作是生态学的子学科,但水生生物学的范围包括分类学、经济生物学、工业生物学、形态学、生理学等。对内陆水体中生物的研究可以分为流水系统生态学 (流动的水体) 和静水系统生态学 (静止的水体)。
目前的研究领域之一是富营养化,它侧重于浮游生物组合中的生物相互作用。水生生物学的这个分支涉及微生物环、水华、磷负荷和湖泊翻转。湖沼学另一个关注的方面是山区湖泊的酸化。正在进行长期研究,以监测由于酸雨和施肥导致的河流、湖泊和水库水体离子组成的变化。当前研究的另一个目标是阐明水库生态系统基本的环境功能,这对水质管理和供水至关重要。

由于环境变化和休闲垂钓,许多鱼类种群在某些栖息地正在减少。作为回应,鱼类孵化场在将鱼类放回自然栖息地(也称为放养)之前,在无捕食者、资源无限的环境中繁殖鱼类。 Power(1994)^ 进行的一项研究调查了萨吉和梭鲈对萨卡卡维亚湖放养的匙吻鲟的捕食。对湖泊三个不同地点的捕食者进行了处死,结果发现 73% 的捕食者至少吞食了一条匙吻鲟。所有被吞食的完好匙吻鲟的大小仅为成鱼的 36-52%。这些发现表明,匙吻鲟在长到足以避免这种捕食之前就被放养到湖泊中。放养的另一个问题是,后代的基因有时不如自然栖息地出生的鱼类优良。在这样的环境中饲养鱼类的弊端是,没有竞争,也没有“适者生存”。
微生物对湖沼学有着巨大的影响。它们在很大程度上负责湖泊中的氮平衡、沼泽中水腐殖质的分解、铁的年度循环以及硫的氧化。库兹涅佐夫(1968)^ 通过孵化水库并使用碳、氮、铁和硫的放射性同位素来监测它们的存在形式以及周转率,研究了这种复杂的循环。微生物建立了一个复杂的循环来维持化学稳定性,这使得各种水生生物能够繁衍生息。
演替
[edit | edit source]演替的概念最初是由克莱门茨 (1916) 清楚地提出的。该术语的经典用法涉及三个基本概念(根据 Mitsch 和 Gosselink,1986)
- 植被存在于可识别的群落中;
- 群落随时间的变化是由于现有的生物群改变了环境造成的(变化是自生的);
- 变化是线性的,并且朝着顶极生态系统(Odum,1971)发展。
演替是指生态群落组成或结构的可预测且有序的变化。它是对受干扰区域的殖民化,最终会导致物种多样性的增加。演替分为两个阶段 - (1) 初级演替和 (2) 次级演替。

初级演替涉及裸地的重新殖民化。初级演替具有r 选择生物--可以在高干扰区域生存并且生长迅速的生物。有几个因素会导致干扰 - (1) 人类,(2) 疾病,(3) 火灾,(4) 降水/洪水,(5) 风/飓风/龙卷风,(6) 极端温度(如冻结或极度高温),以及 (7) 火山。换句话说,处于早期演替的群落将以生长迅速、分布广泛的物种为主。随着演替的进行,演替的另一个阶段将被更具竞争力的物种取代 Wikipedia:en:Ecological succession/Succession。圣海伦斯火山 1980 年喷发后的生态反应就是一个很好的初级演替的例子。Bishop 等人。2005 年[6] 描述了像圣海伦斯火山这样的初级演替景观可以教会我们描述生态群落形成和功能的基本机制。这些机制的使用和理解可能会导致受灾景观的恢复。
演替的另一个阶段是次级演替,它是部分清理区域的重新殖民化(发生在初级演替之后)。最终,次级演替/殖民化会导致成熟的群落,称为顶极群落,它们是稳定的群落。次级演替群落具有k 选择生物--最有效地利用限制性资源,因此可以战胜其他个体的生物。次级演替可能包括顶级群落--生态演替中发现的中间阶段,该阶段朝向其顶极群落发展。
- 阅读 Succession
参考文献
[edit | edit source]- [7] Bishop, John, G. 2005. "Causes and consequences of herbivory on prairie lupine (Lupinus lepidus) in early primary succession" Ecological Responses to the 1980 Eruption of Mount St. Helens 1:151-161
- [8] Belcher, W. Joyce 1989. "Leafy spurge and the species composition of a mixed-grass prairie" Journal of Range Management 42(2): 172-175
- Braatne, Jeffrey H. 2005. Stream Ecology class website at the University of Idaho).
- Clements, E. E. 1916. Plant Succession. Carnegie Inst. of Washington, Pub. 242: 512 pp.
- [9] Frissell, Christopher A.; Bayles, David. 1996. "Ecosystem Management and the Conservation of Aquatic Biodiversity and Ecological Integrity" Water Resources Bulletin 32(2):229-240
- [10] Jackson, J.B.C. 1997. "Reefs since Columbus." Coral Reefs. 16: S23-S32.
- [11] Kuznetsov, S. I. 1968. “Recent Studies on the Role of Microorganisms in the Cycling of Substances in Lakes.” Limnology and Oceanography. 13, 211–224.
- Mitsch, William J., and James G. Gosselink. 1986. Wetlands, New York: Van Nostrand Reinhold. 539 pp.
- [12] Nielsen, D.L.; Brock M.A.; Rees, G.N; Baldwin D.S. 2003. "Effects of increasing salinity on freshwater ecosystems in Australia" Australian Journal of Botany 51:655-665
- Odum, E. P. 1959. Fundamentals of ecology. W. B. Saunders Co., Philadelphia and London. 546 p.
- Odum, E. P. 1971. Fundamentals of ecology. 3rd edition. W. B. Saunders Co., Philadelphia and London. 544 pp.
- [13] Power, G. J. 1994. “Walleye and Sauger Predation on Paddlefish in Lake Sakakawea, North Dakota.” North Dakota Journal of Fisheries Management. 14, 226–227.
- [14] Roman, Charles T, et al. 2000. “Estuaries of the Northeastern United States: Habitat and Land Use Signatures.” Estuaries. 23(6): 743–764.
- Tansley, A. G. 1935. The use and abuse of vegetational concepts and terms. Ecology, 16(3): 284–307.
