普通化学/各种元素的化学/过渡金属
过渡金属位于元素周期表的中间。对过渡金属有两个定义
- 所有d区元素(3-12族)
- 具有部分填充d轨道的元素,或可以形成具有部分填充d轨道的阳离子的元素
第一个定义更为普遍,在日常使用中更为常见,但第二个定义强调了过渡金属的独特性质,是IUPAC(国际纯粹与应用化学联合会)使用的定义。第二个定义通常被认为不包括Zn、Cd和Hg,因为这些元素具有d10电子构型(d轨道完全填充,而不是部分填充)。然而,最近报道的具有d8构型的氟化汞(IV)化合物使这种排除变得可疑,使考虑Hg(以及可能还有Zn和Cd)为过渡金属变得合理。
过渡金属的行为与其他金属不同,因为它们具有部分填充的d轨道。向过渡金属添加电子不会影响其价层,因为电子进入d轨道(它不是价层的一部分)。所有过渡金属都具有一个或两个价电子。
过渡金属很有趣,因为它们可以具有多种氧化态,不像大多数其他金属。这是因为过渡金属在形成离子时,除了s电子之外还可以失去d电子。

记住,当电子轨道充满或半满(或空)时,它最稳定。研究过渡金属的电子构型显示出一个有趣的模式
| Sc | [Ar]4s23d1 |
| Ti | [Ar]4s23d2 |
| V | [Ar]4s23d3 |
| Cr | [Ar]4s13d5 |
| Mn | [Ar]4s23d5 |
| Fe | [Ar]4s23d6 |
| Co | [Ar]4s23d7 |
| Ni | [Ar]4s23d8 |
| Cu | [Ar]4s13d10 |
| Zn | [Ar]4s23d10 |
为了更加稳定,铬和铜中的一个s电子“跃迁”到d轨道。这也会发生在较重的过渡金属中,例如钼、钨和铂。对于周期5、6和7中的较重过渡金属,相对论的影响导致轨道能级的变化。在这些元素中,s电子比预期更容易“跃迁”到d层,遵循充满/半满规则。
当过渡金属离子形成时,它们首先失去s电子,然后如果进一步电离,它们会失去d电子。例如,铜可以形成两种不同的离子,钛可以形成三种
| Cu | [Ar]4s13d10 |
| Cu+ | [Ar]4s03d10 |
| Cu2+ | [Ar]4s03d9 |
| Ti | [Ar]4s23d2 |
| Ti2+ | [Ar]4s03d2 |
| Ti3+ | [Ar]4s03d1 |
| Ti4+ | [Ar]4s03d0 |
过渡金属及其氧化物在溶解时会形成有色化合物。1族和2族金属溶解时是透明的,沉淀时是白色的。其他金属,如铅,溶解时是透明的,沉淀时可能会有颜色(铅沉淀物是黄色的)。另一方面,过渡金属溶解时是有色的。不同的金属以其特定的颜色而闻名,被用作墨水或油漆。

"货币金属"是铜、银、金和钅罗。这些元素的用途远不止硬币,除了这些元素之外,还有许多其他元素被制成硬币。此外,钅罗是一种放射性元素,半衰期为3.6秒,使其无法用于商业应用。因此,"货币金属"更恰当地称为11族(IB)元素。
铜、银和金,尽管相对稀有(铜)、稀有(银)或极其稀有(金),但它们是最早为人所知且最熟悉的元素之一。它们是柔软、光亮、致密的金属,耐腐蚀,并且是良好的导电体。钅罗是一种最近发现的合成元素,寿命很短,因此其物理和化学性质尚未得到很好的定义。
铜因其电气特性、常见性(与银和金相比)以及黄铜和青铜合金的吸引力而成为这些元素中使用最广泛的元素。在铝成为常见金属之前,铜在金属产量中仅次于铁。
-
铜管
-
最光亮的银
-
金
它们很容易识别,因为铜(红色)和金(黄色)是人们可能遇到的两种有色金属。银是金属中最光亮的,通常与铜或金一起发现,形成鲜明的对比。它们通常以游离态存在。
由于柔软,它们很容易被敲击成硬币,而且它们相对稀有和具有吸引力,再加上它们耐腐蚀,使它们成为财富的紧凑储存器。它们太软而没有结构价值,但铜合金与锌和锡等元素形成更硬的黄铜和青铜。黄铜和青铜是早期金属工具中必不可少的;没有它们,我们所知的文明将是不可能的。金和银由于其吸引力和耐氧化性,已被大量用于珠宝和其他装饰作品。金虽然非常昂贵,但它非常具有延展性,以至于少量金可以以适中的成本被锤成极薄的箔,使它可以被用作一些建筑物表面的覆盖层;少量金可以走很远。
铜在卤化物和氧化物中难以氧化至+1价,在硫酸铜 CuSO4 等盐中氧化至+2价。可溶性铜化合物很容易通过其独特的蓝绿色来识别。银在硝酸银 AgNO3 和硫化银 Ag2S 等物质中氧化至+1价,后者是银的典型变黑。金极难氧化至+1价和+3价。
这些元素是弱(铜)到极弱(金)的还原剂,它们的化合物是非常好的氧化剂。铜离子氧化大多数金属
与银或金的反应更强。实际上,这些金属盐的溶液可以镀在大多数其他金属上。
银是电导率最高的金属,其次是铜,然后是金。这使得铜成为电线的首选材料。金尖电线用于需要电气精度的场合(如高品质音频),因为金不会变色(铜的变色导电性要低得多)。
锌族
[edit | edit source]锌、镉和汞是金属,其熔点对于金属来说很低。这是因为它们具有特别稳定的电子构型。汞在形成金属键方面非常差,以至于它在室温下是液体。
-
一枚锌币
-
镉块
-
一滩汞
锌和镉是软金属,很容易氧化成+2价态。这两种金属都没有以游离态出现在自然界中。锌被大量用于与铜的合金中,以制造一种更硬的金属,称为黄铜;作为铁的涂层(该过程称为“镀锌”),它氧化形成一层保护性的氧化锌 (ZnO) 层,保护铁不被氧化,也称为生锈。氧化锌比氧化铅安全得多,通常用于白漆。自1982年以来,锌一直是美国分币使用的主要金属。现在它被用于新的风琴管。
镉形成两种物质,镉黄(硫化镉,CdS)和镉红(硒化镉,CdSe),它们出现在油漆中。这些颜料具有强烈的颜色,许多印象派时期的大艺术家在他们的绘画中喜爱这些颜色。但这些物质剧毒,使用它们的画家经常英年早逝,并且残疾。现代画家通常使用不含这两种有毒化学物质的不同颜料。
相反,汞在室温下是闪亮的液体,并且很难氧化。它导电性良好。由于它是液体,它是一种不寻常的金属——但它是一种金属。它已被用于温度计(但自被认定为危险毒物后就不那么常用了),因为它会随着热量膨胀,以及在开关中,它可以流入封闭的空间以闭合电路。汞在氯化汞 (HgCl2) 中氧化至+2价;在一些奇怪的化合物中,两个汞原子共享一个电子,并提供它们“剩余”的电子来形成+1价态的物质,如氯化亚汞 (Hg2Cl2)。
锌是生物体必需的微量元素;它具有一定的杀菌作用,并且大量存在时有毒。锌分币切勿吞食。镉、汞及其化合物是剧毒物质。尽管汞具有吸引力并且具有非凡的特性,但应谨慎使用,并且只能由了解其危害的工人使用。
2010年命名的第112号人工元素鎶,其性质可能属于该族的一部分,但它极难产生,而且太不稳定,无法确定其化学性质。迄今为止,这种元素只制备了很少的原子。
第8、9和10族的元素分为两个不同的组:第一行过渡金属中的常见元素铁、钴和镍以及第二行和第三行中的铂族金属,以及更稀少的两个下行过渡元素中的铂族金属。
铁、钴和镍
[edit | edit source]这些元素是相当好的还原剂——好到它们很少以游离态出现在自然界中。铁是其中最常见的元素。它是宇宙中最常见的元素之一,也是在恒星中通过正常核聚变形成的最重的金属(但只有最大的恒星)。当恒星开始在其核心产生铁时,这颗恒星注定将在很短的时间内发生剧烈的爆炸,摧毁恒星并散布其物质,包括它在核聚变中形成的所有元素。
游离铁、钴和镍——特别是铁——可以在陨石中找到,陨石是撞击地球的固体物体。铁是过渡元素中最常见的,也是最有用的元素之一。很难计算出铁的所有用途,铁是几乎所有机器中使用最多的金属(无论是纯金属还是合金)。巨大的“玻璃盒子”摩天大楼依赖于其混凝土“骨架”内的铁棒,以赋予它们强度和稳定性。铁路的轨道是长长的铁棒。混凝土公路和飞机跑道有铁筋,以赋予它们承受重型车辆的强度。车辆本身主要由铁和一种更硬的材料制成,称为钢,它是铁、碳和通常不含铁的金属的合金。
铁是最便宜的结构金属。通过被称为铁匠的工匠的一些技巧,它可以被加工成许多有用的物品,如马蹄铁、钉子、犁、链条、桶、梯子和许多工具。在铸造厂,铁和钢以更大的数量被塑造成家具和飞机、船舶、机动车和电器部件等物品。
铁作为结构材料有一个缺陷:它容易生锈。在有水(特别是盐水)的情况下,它会腐蚀成氧化物
Fe(s) + 1/2 O2(g) → FeO(s) 2 Fe(s) + 3/2 O2(g) → Fe2O3(s)
以及一种称为赤铁矿的混合氧化物
2 Fe(s) + 3/2 O2(g) → Fe2O3(s)
是铁最常见的矿石之一。氧化铁呈弱碱性,因此铁能抵抗碱的侵蚀;酸会侵蚀它。例如,
Fe (s) + H2SO4(l) → Fe2+(aq) + SO42-(aq) + H2(g)
即使是相对较弱的酸,如磷酸,也可以侵蚀氧化铁。这就是“海军果冻”反应,它可以去除铁锈
FeO(s) + H3PO4(l) → Fe2+(aq) + HPO4(aq)-2 + H2O(l)
人类的一大进步,即铁器时代的开始,始于人们发现可以通过用碳(通常是木炭)燃烧来从氧气中分离铁,碳可以将氧化铁还原成铁
Fe3O4(s) + 4 C(s) → 3 Fe(s) + 4 CO(g)
现有的许多经济活动都依赖于铁矿石的开采、铁矿石的还原、铁的强化成钢、铁和钢制品的制造以及保护铁免受腐蚀的各种做法。
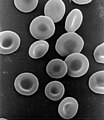
这项活动虽然重要,但我们的生活不可能没有一种叫做血红蛋白的重要铁化合物,血红蛋白通过血流将氧气输送到细胞,细胞可以使用氧气从通过血流输送到细胞的食物中释放能量。
-
两座悬索桥
-
一把旧的铁犁
-
红细胞含有血红蛋白
-
一块电磁铁正在吸引废铁
地球本身有一个由主要由铁和镍组成的热而致密的核心。在地球核心的特征温度下,铁和镍形成了一个巨大的天然磁铁,产生了一个磁场,该磁场延伸到地球本身之外进入大气层。该磁场驱散了大量危险的辐射,如果这些辐射到达地球表面,将杀死地球表面的生命。
钴和镍都比铁稀少得多,并且在商业上没有铁那样广泛使用,尽管它们有专门的用途。
铂族金属包括钌、铑、钯、锇、铱和铂。这些元素位于第 8/9/10 族 (IIIB) 的最后两行。
与这些元素在第 8、9 和 10 族中的较轻同类元素不同,它们耐腐蚀和变色。它们用作许多化学反应的催化剂,加速反应而不会被反应消耗。
钯、锇和其他铂族金属在粉末状时会吸收氢气。
铑用于催化转化器 - 汽车内部的金属结构。催化转化器将氮氧化物(有毒污染物)转化为元素氮和氧气(两者都是可呼吸空气的组成部分)
如果没有铑作为催化剂,该反应就不会发生。