普通化学/八隅体规则及其例外
八隅体规则是指原子倾向于在其价层(外层轨道)中具有八个电子的趋势。当原子具有少于八个电子时,它们往往会发生反应并形成更稳定的化合物。在讨论八隅体规则时,我们不考虑 d 或 f 电子。只有 s 和 p 电子参与八隅体规则,这使得它对代表元素(不在过渡金属或内过渡金属块中的元素)很有用。八隅体对应于以 s2p6 结尾的电子构型。
原子会发生反应以达到最稳定的状态。完整的八隅体非常稳定,因为所有轨道都将被填满。稳定性越高的原子能量越低,因此增加原子稳定性的反应会以热量或光的形式释放能量。降低稳定性的反应必须吸收能量,变得更热。
原子的另一个趋势是保持中性电荷。只有稀有气体(元素周期表最右边一列的元素)具有充满价层八隅体的零电荷。所有其他元素在它们具有八个电子时都带有电荷。这两个指导原则的结果是对原子内观察到的许多反应性和键合的解释:原子试图以一种最小化电荷并满足价层八隅体的共享电子方式。
稀有气体很少形成化合物。它们具有最稳定的构型(完整的八隅体,无电荷),因此它们没有理由反应并改变它们的构型。所有其他元素都试图获得、失去或共享电子以达到稀有气体构型。 |
食盐的化学式是 NaCl。它是 Na+ 离子与 Cl- 离子键合在一起的结果。如果钠金属和氯气在合适的条件下混合,它们将形成盐。钠失去一个电子,氯得到那个电子。在这个过程中,会释放大量的热和光。由此产生的盐大多不活泼——它是稳定的。它不会发生任何爆炸反应,不像它所制成的钠和氯。
为什么?根据八隅体规则,原子试图获得稀有气体电子构型,即八个价电子。钠有一个价电子,所以放弃它会导致与氖相同的电子构型。氯有七个价电子,所以如果它得到一个,它将有八个(一个八隅体)。氯在得到一个电子时具有氩的电子构型。
如果氯放弃它所有的七个价电子,而钠得到它们,那么八隅体规则就可以得到满足。在这种情况下,两者都将具有稀有气体的电子构型,具有完整的价层。然而,它们的电荷将高得多。它将是 Na7- 和 Cl7+,这比 Na+ 和 Cl- 不稳定得多。原子在没有电荷或少量电荷时更稳定。
八隅体规则有几个例外。
该规则的主要例外是氢,当它在价层中有两个电子时,它处于最低能量状态。氦 (He) 类似,因为它也只有一个价层,而且它只能容纳两个电子。
氢和氦只有一个电子层。第一层只有一个 s 轨道,没有 p 轨道,因此它只容纳两个电子。因此,这些元素在具有两个电子时最稳定。你偶尔会看到氢没有电子,但 H+ 比具有一个或两个电子的氢不稳定得多。
锂,具有三个质子和电子,在放弃一个电子时最稳定。
其他值得注意的例外是铝和硼,它们可以用六个价电子很好地发挥作用。考虑 BF3。硼将它的三个电子与三个氟原子共享。氟原子遵循八隅体规则,但硼只有六个电子。虽然具有少于八隅体的原子可能是稳定的,但它们通常会尝试形成第四个键以获得八个电子。BF3 是稳定的,但它会在可能的情况下形成 BF4-。大多数位于碳族左侧的元素拥有很少的价电子,因此它们与硼处于相同状态:它们是电子不足的。电子不足的元素通常表现出金属键合而不是共价键合。
在第三周期,元素周期表右侧的元素有空的 d 轨道。d 轨道可以接受电子,允许硫、氯、硅和磷等元素具有超过八隅体的电子。可以形成像 PCl5 和 SF6 这样的化合物。这些化合物分别在其中心原子周围具有 10 和 12 个电子。

|
六氟化氙使用 d 电子形成超过八隅体的化合物。这种化合物显示了另一个例外:一种稀有气体化合物。 |
甚至钯在其价层中也有 18 个电子
一些元素,特别是氮,具有奇数个电子,会形成相对稳定的化合物。一氧化氮的化学式为 NO。无论氮原子和氧原子之间如何共享电子,氮都无法形成八隅体。它将只有七个电子。含有未配对电子的分子称为自由基,自由基具有很高的反应活性,反应活性如此之高,以至于许多自由基只存在于不到一秒的时间内。在自由基中,NO 和 NO2 实际上非常稳定。在低温下,NO2 会与自身反应生成 N2O4,其二聚体,不是自由基。
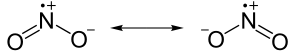
|
二氧化氮具有一个未配对电子。(注意 N 上面的正电荷)。 |
