普通化学/相变
外观
< 普通化学
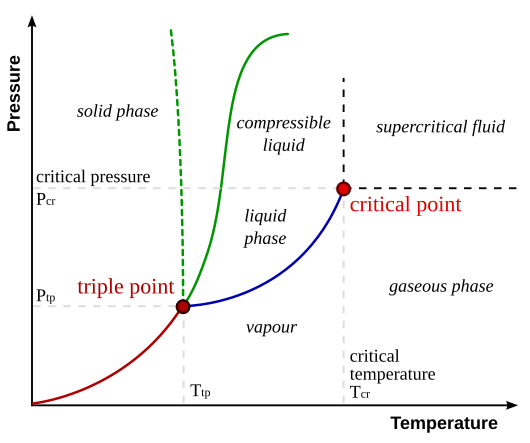
相图预测物质在一定压力和温度下的相态。
三相点是所有三种物质相态可以平衡共存的点。处于线上的点表示两种物质相态可以共存。
临界点是三种正常相态能够存在的最高压力和温度。超过这个点,物质的特性会变成液体和气体的混合。
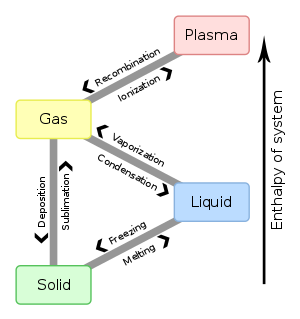
如果温度和压力发生变化,并且在图上跨越一条线,相态也会发生变化。这种变化可以有六种方式:
- 固态到液态:熔化
- 液态到固态:凝固
- 液态到气态:蒸发
- 气态到液态:冷凝
- 气态到固态:凝华
- 固态到气态:升华
右边的图还显示了物质的等离子体状态。 等离子体 仅仅是完全电离的气体,所以它包含正离子与电子的混合物。它具有有趣的电学性质,但在普通化学的范围内并不重要。
| 提示! | |
|---|---|
| 分子的动能与其温度成正比。势能用于断开键。 |
如果你把水煮沸,它永远不会超过 100 摄氏度。只有在它完全蒸发后才会变热。这是因为一旦水达到沸点,额外的能量被用来改变物质的状态,增加势能而不是动能。当水结冰时,会发生相反的事情。要沸腾或熔化一摩尔物质,需要一定的能量。这些能量被称为摩尔汽化热和摩尔熔化热。如果在沸点或凝固点向一摩尔物质添加这些能量,它将全部熔化或沸腾,但温度不会改变。
该图显示了冰在添加热量时的温度变化。温度随着热量线性增加,直到熔点。然后,添加的热量不会改变温度。这些热量被用来断开分子间键,将冰转化为水。此时,存在冰和水的混合物。一旦所有的冰都融化,温度会再次随着添加的热量线性上升。在沸点,温度不再随热量增加而上升,因为能量再次被用来断开分子间键。一旦所有的水都沸腾成蒸汽,温度会随着热量的增加而线性上升。