普通化学/氧化还原反应/电化学
氧化还原(reduction/oxidation reaction 的缩写)描述所有原子氧化数(氧化态)发生改变的化学反应。
这可以是一个简单的氧化还原过程,例如碳氧化生成二氧化碳,或者碳被氢还原生成甲烷(CH4),也可以是一个复杂的氧化还原过程,例如糖在人体内通过一系列非常复杂的电子传递过程发生氧化。
氧化还原一词来自还原和氧化这两个概念。它可以用简单的话解释
- 氧化描述的是一个分子、原子或离子失去电子
- 还原描述的是一个分子、原子或离子获得电子
然而,这些描述(尽管对于许多目的来说已经足够)并不完全正确。氧化和还原实际上是指氧化数的变化——电子的实际转移可能永远不会发生。因此,氧化最好定义为氧化数的增加,还原最好定义为氧化数的减少。在实践中,电子的转移总是会导致氧化数的变化,但也有许多反应被归类为“氧化还原”,即使没有电子转移发生(例如那些涉及共价键的反应)。
电化学是化学的一个分支,它处理化学反应中电流的流动。平衡半反应中的电子显示了电流与特定氧化还原反应之间的直接关系。电化学反应是自发的,或者是非自发的。自发氧化还原反应会自行产生电压。非自发氧化还原反应发生在施加外部电压的情况下。在电池中发生的反应就是电化学反应。
- 电化学反应的三个组成部分
- 一个溶液,氧化还原反应可能发生在其中(溶液是溶解在液体(通常是水)中的物质)
- 一个电子传递的导体(例如金属导线)
- 一个离子传递的导体(通常是盐桥)例如浸泡在盐溶液中的滤纸。
电解实验迫使非自发化学反应发生。当两个电极浸入导电溶液中,并且施加在两个电极上的电电压增加到足以使电子流动的程度时,就会实现这一点。接收电子的电极,或者发生还原反应的电极,被称为阴极。提供电子的电极,或者发生氧化反应的电极,被称为阳极.
熔融盐就是一个可以电解的例子,因为盐是由离子组成的。当盐处于固态时,离子不能自由移动。然而,当盐被加热到足以熔化(使其成为熔融盐)时,离子就可以自由移动。熔融盐中离子的这种流动性使得盐具有导电性。在熔融盐的电解中,例如熔化的,盐的阳离子(在本例中为)将在阴极被还原,盐的阴离子(在本例中为)将在阳极被氧化
- 阴极反应: Na+ + e- → Na
- 阳极反应: 2Cl → Cl2 + 2e-
盐的水溶液也可以电解,因为它们也具有导电性。在水溶液中,阴极和阳极都可能发生额外的反应
- 阴极: 2H2O + 2e- → H2 + 2OH- (水的还原)
- 阳极: 2H2O → 4H+ + O2 + 4e- (水的氧化)
结合以上两个反应,现在每个电极都有两个可能的反应。在阴极,阳离子的还原或水的还原都会发生。在阳极,阴离子的氧化或水的氧化都会发生。以下规则决定了每个电极上发生的反应。
- 阴极: 如果阳离子是活性很强的金属,水会被还原。活性很强的金属包括 Li、Na、K、Rb、Cs、Ca、Sr 和 Ba。如果阳离子是活性金属或非活性金属,阳离子会被还原。
- 阳极: 如果阴离子是多原子离子,水通常会被氧化。具体来说,硫酸根离子、高氯酸根离子、硝酸根离子不会被氧化;水会代替它们被氧化。氯离子、溴离子和碘离子会被氧化。如果一种盐中的阴离子在水溶液电解中被氧化,那么在任何其他盐中,该阴离子也会被氧化。
使用**原电池**捕捉自发氧化还原反应的能量。以下部分是构成原电池的必要条件
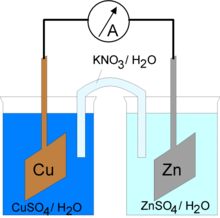
原电池的结构如右图所示。两个半反应被分成两个半电池。氧化半反应中的所有反应物被置于一个半电池(阳极)中,还原半反应中的所有反应物被置于另一个半电池(阴极)中。如果半反应中含有金属,金属充当该半电池的电极。否则,使用铂、银或金制成的惰性电极。电极通过导线连接,允许电子流动。电子始终从阳极流向阴极。半电池通过盐桥连接,允许溶液中的离子从一个半电池移动到另一个半电池,以便反应能够继续进行。由于总反应是自发的,电子将自发地流过外电路,从中可以提取能量。所获得的能量是有用的,因为它可以用来做功。例如,如果将一个电气元件(如灯泡)连接到导线上,它将从流动的电子中获得能量。
原电池的稳定结果取决于三个变量:压力、温度和浓度。因此,化学家定义了原电池的标准状态。原电池的标准状态是所有气体为 1.00 大气压 (atm),温度为 298 开尔文 (K),所有可溶性化合物、液体和固体的浓度为 1.00 摩尔 (M)。
电压是衡量氧化还原反应自发性的指标,可以用电压表测量。如果反应的电压为正,则反应自发发生,但如果为负,则不会自发发生。
为了计算氧化还原方程式的电压,将该方程式分解为其氧化部分和还原部分。然后,在标准电极电势表上查找每个部分的电压。该表格将列出还原方程式的电压。氧化反应的电压是其对应还原方程式的电压的负值。要找到方程式的电压,将每个半反应的标准电压相加。
对于那些对氧化还原反应的更细致内容感兴趣的人,可以参考以下书籍



