普通化学/电子层和轨道
每个电子层都细分为亚层,亚层由轨道组成,每个轨道上的电子具有不同的角动量。每个亚层中的轨道都有一个特征形状,并用字母命名。它们是:s、p、d 和 f。在一个单电子原子(如 H、He+、Li+2 等)中,特定电子层内每个轨道的能量是相同的。然而,当存在多个电子时,它们会相互作用并使轨道分裂成略微不同的能量。字母 s、p、d 和 f 指定了亚层(角量子数 l),轨道由磁量子数 m 指定。角量子数和磁量子数分别与电子的角动量的幅度和方向有关。在任何特定亚层中,轨道的能量取决于 s、p、d 和 f 轨道的角动量,按照从最低到最高的能量顺序排列。
此图像显示了轨道(以及用于键合的杂化轨道和一个样本电子构型,将在后面解释)。 
原子中最简单的亚层是 1s 亚层。它没有径向或角节点:1s 亚层只是一个电子密度的球体。节点是电子位置概率为零的点。与所有亚层一样,径向节点的数量随着主量子数的增加而增加(即 2s 轨道有一个径向节点,3s 有两个,依此类推)。因为角动量量子数是 0,所以磁量子数只有一个选择 - 每个电子层只有一个 s 轨道。s 轨道可以容纳两个电子,只要它们具有不同的自旋量子数。s 轨道参与键合。
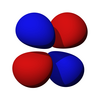
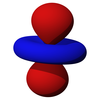
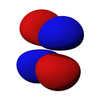
从第二层开始,有一组 p 亚层。限制在 p 亚层中的电子的角动量量子数是 1,因此每个轨道都具有一个角节点。磁量子数有 3 个选择,这表明有 3 个不同方向的 p 亚层。最后,每个轨道可以容纳两个电子(自旋相反),使 p 轨道总容量为 6 个电子。
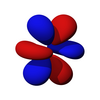
p 亚层的轨道都具有沿着每个轴指向的两个电子密度瓣。每个轨道沿其轴是对称的。p 亚层的轨道符号表明它指向哪个轴,例如,px 沿 x 轴指向,py 沿 y 轴指向,pz 沿 z 轴上下指向。请注意,虽然 pz 对应于 ml = 0 轨道,但 px 和 py 实际上是 ml = -1 和 ml = 1 轨道的混合物。p 轨道是简并的 - 它们都具有相同的能量。p 轨道经常参与键合。
| 2px | 2py | 2pz |
|---|---|---|

|

|

|
第一组 d 轨道是 3d 组。角动量量子数是 2,因此每个轨道都有两个角节点。磁量子数有 5 个选择,这导致 5 个不同的 d 轨道。每个轨道可以容纳两个电子(自旋相反),使 d 轨道总容量为 10 个电子。
需要注意的是,除了dz2轨道有两个相对的瓣和一个环状的电子密度外,所有d轨道都有四个电子密度瓣。d轨道可以进一步细分为两个子集。dx2-y2和dz2轨道都直接指向x,y和z轴,形成一个**eg**子集。另一方面,dxy,dxz和dyz轨道的瓣都排列在象限中,在轴上没有电子密度。这三个轨道形成一个**t2g**子集。在大多数情况下,d轨道是**简并的**,但有时它们会分裂,eg和t2g子集会有不同的能量。**晶体场理论**预测并解释了这一现象。d轨道有时参与成键,特别是在无机化学中。

|
|
|
|

|
f 子层
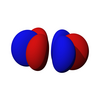
[edit | edit source]第一组f轨道是4f子层。有7个可能的磁量子数,所以有7个f轨道。它们的形状相当复杂,在化学学习中很少出现。由于每个轨道可以容纳两个电子(自旋相反),所以有14个f电子。
|

|

|

|
|

|

|




