有机化学/烷烃
烷烃是最简单的有机分子,仅由单键连接的碳和氢原子组成。烷烃被用作命名大多数有机化合物的基础(它们的 **命名法**)。烷烃的通式为 CnH2n+2。尽管它们的反应性通常不太有趣,但它们为理解成键、构象和其他可以推广到更“有用”的分子中的重要概念提供了良好的基础。

烷烃的例子
烷烃是最简单的,也是反应活性最低的 烃 类,只含有碳和氢。它们在商业上非常重要,是汽油和润滑油的主要成分,在有机化学中得到广泛应用;虽然纯烷烃(如己烷)的作用主要局限于溶剂。
烷烃的显著特征是它没有 不饱和,这使其有别于其他仅含有碳和氢的化合物。也就是说,它不包含双键或三键,它们在有机化学中具有高度反应性。
尽管烷烃并非完全没有反应活性,但它们在大多数实验室条件下缺乏反应性,使其成为有机化学中相对不有趣但非常重要的组成部分。正如您将在后面学到的,碳-碳键和碳-氢键中包含的能量相当高,它们的快速氧化会产生大量的热,通常以火的形式出现。
正如所说,它很重要,但在化学中并不是一个非常重要的组成部分。
有机化合物按定义含有碳和氢,通常还含有其他元素(如氮和氧)。(CO2不是有机化合物,因为它没有氢)。
烃是有机化合物,只含有碳和氢。
烷烃是由碳-碳单键组成的烃或有机化合物。因此它们是饱和的(与双键和三键相反)。最简单的烷烃是 **甲烷。**
甲烷(CH4,一个碳原子与四个氢原子键合)是最简单的有机分子。它是 标准温度和压力 (STP) 下的气体。

|
| 甲烷 |
这是一个扁平的、二维的甲烷表示,您将经常看到它。甲烷的真实三维形式在键合的氢之间没有 90 度角。键指向四面体的四个角,形成 cos-1(-1/3) ≈ 109.5 度键角。

两个碳原子通过单键彼此连接,并带有六个氢原子,被称为乙烷。
乙烷是第二简单的烃分子。可以认为它是两个甲烷分子连接在一起,但少了两个氢原子。请注意,如果我们只是简单地在两个甲烷分子的碳中心之间创建一个新键,这将违反参与原子的八隅体规则。
有几种常用的方法来绘制有机分子。它们经常互换使用,尽管有些方法更适合一种情况或另一种情况。熟悉常用方法很重要,因为这些是“语言”,有机化学家可以用来相互讨论结构。
在写出烷烃结构时,您可以根据需要使用不同级别的简写。例如,戊烷可以写出来。它的化学式是 C5H12。
或 CH3–CH2–CH2–CH2–CH3,
或 CH3(CH2)3CH3,
虽然非环状烷烃被称为直链烷烃,但从技术上讲它们是由连接的链组成的。这反映在线绘制方法中。线上的每个端点和弯曲都代表一个碳原子,每条短线代表一个单键的碳-碳键。假设每个碳都包围着最大数量的氢原子,除非另有说明。
| 丙烷、丁烷、戊烷 |
没有明确显示所有碳原子的结构通常被称为“骨架”结构,因为它们代表分子的骨架或主链。在有机化学中,碳的使用非常频繁,因此化学家知道在没有特别标记的每条线的端点处都有一个碳原子。
构象异构体,也称为构象异构体或旋转异构体或旋转异构体,是同一个分子的排列,通过围绕一个或多个单键在空间中的旋转而变得暂时不同。
其他类型的异构体只能通过断裂键从一种形式转换为另一种形式,但构象异构体可以通过简单地旋转键来生成。
纽曼投影是一种用于表示分子不同部分在空间中相对位置的图示方法。请记住,单键可以在空间中旋转,除非受到阻碍。纽曼投影代表旋转分子部分的不同位置。
| 构象异构体易于相互转化,通常每秒发生数千次,因为分子的一部分会旋转。 | 
|
| 在下图中,甲基位于分子的前后端,一个圆圈代表所有位于其之间的部分。 |
 |
 |
|
|
(前端与后端重叠,也不稳定) |
构象和能量
[edit | edit source]不同的构象具有不同的势能。交叉式构象的势能低于重叠式构象,因此更稳定。在乙烷中,旋转能垒约为 25 kJ/mol,表明每对重叠的氢原子会使能量升高约 8 kJ/mol。这个数字也适用于其他具有氢原子彼此距离相似的有机化合物。在极低温度下,所有构象都会恢复到更稳定的(由于原子在平均位置振动最小)低能交叉式构象。
空间效应
[edit | edit source]空间效应与尺寸有关。两个体积大的物体相互碰撞,侵入彼此的空间。如果我们用甲基或其他基团取代上述纽曼投影中的一个或多个氢原子,势能会上升,特别是对于重叠式构象。
让我们看一下丁烷在绕其轴逆时针旋转时的纽曼投影。
 |
 |
 |
 | |||
当较大的基团重叠时,它们之间的排斥作用比氢原子之间的排斥作用更强,势能会上升。
熵
[edit | edit source]熵,表示为ΔS,是一个数学概念,代表无序或概率。自然系统想要找到可能的最低能量或组织状态,这转化为最高的熵。
关于势能的说明:如果你对这个概念生疏,请记住将一块大石头推到山顶的类比。在山顶,它具有最大势能。当你推动它并让它滚下山坡时,它所储存的势能会转化为动能,可用于产生热量或粉碎东西。
请注意,从统计学上讲,乙烷分子处于邻位构象的机会是处于反式构象的两倍。然而,由于邻位构象使甲基彼此靠近,这会产生高能的空间相互作用,因此在没有能量输入的情况下不会发生这种情况。因此,所示的丁烷分子几乎不会处于这种不利构象。
烷烃的制备
[edit | edit source]武兹反应
[edit | edit source]武兹反应是在诸如无水乙醚之类的溶剂中使用钠金属偶联卤代烷烃。
2R-X + 2Na → R-R + 2Na+X−
机理
[edit | edit source]该反应包括涉及自由基物种 R• 的卤素金属交换(与格氏试剂的形成方式类似,然后在亲核取代反应中形成碳碳键)。
金属中的一个电子转移到卤素,生成卤化金属和烷基自由基。
- R-X + M → R• + M+X−
然后烷基自由基从另一个金属原子中接受一个电子,形成烷基阴离子,金属变成阳离子。这种中间体在几个案例中已被分离出来。
- R• + M → R−M+
然后烷基阴离子的亲核碳在 SN2 反应中取代卤素,形成新的碳碳共价键。
- R−M+ + R-X → R-R + M+X−
- 科里-豪斯反应
- [也称为“卤代烷烃与有机金属化合物的偶联”]。
- 它是比武兹反应更好的方法。卤代烷烃和二烷基铜锂反应生成高级烃。
- R'-X + R2CuLi---->R-R' + R-Cu + LiX
- (R 和 R' 可以相同或不同)
- 它
克莱门森还原
[edit | edit source]克莱门森还原是使用锌汞齐和盐酸将酮(或醛)还原为烷烃的反应。
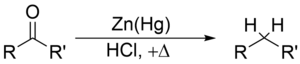
克莱门森还原在还原芳基烷基酮方面特别有效。对于脂肪族或环状酮,锌金属还原更有效。
底物必须在克莱门森还原的强酸性条件下稳定。对酸敏感的底物应在沃尔夫-基希纳还原中反应,该反应利用强碱性条件;另一种更温和的方法是莫辛戈还原。由于克莱门森还原,参与羰基的碳原子从 sp2 杂化转变为 sp3 杂化。氧原子以一分子水的形式损失。
沃尔夫-基希纳还原
[edit | edit source]
沃尔夫-基希纳还原是一种化学反应,可以将酮(或醛)完全还原为烷烃。羰基化合物与肼缩合形成腙,然后用碱处理,诱导碳还原,同时肼氧化为氮气,生成相应的烷烃。
机理
[edit | edit source]
该机理首先涉及腙的形成,其机理可能类似于亚胺的形成。连续的去质子化最终导致氮气的释放。氮气的释放可以用作该反应的热力学驱动力。该反应也被用于区分醛和酮。
莫辛戈还原
[edit | edit source]首先通过酮与适当的硫醇反应生成硫缩酮。然后使用雷尼镍将产物氢解为烷烃。

烷烃的性质
[edit | edit source]与其他化学物质相比,烷烃的反应性很低。这是因为烷烃中的主链碳原子通过形成四个共价键(根据八隅体规则允许的最大键数;这就是为什么碳的价数是 4)获得了它们的八个电子。烷烃中碳形成的这四个键是 σ 键,由于碳的原子轨道与相邻原子的原子轨道的重叠更大,因此比其他类型的键更稳定。为了使烷烃发生反应,需要输入额外的能量;可以通过热量或辐射来实现。
汽油是烷烃的混合物,与许多化学物质不同,它可以长期储存和运输而不会出现问题。只有在点燃时,它才具有足够的能量来继续反应。这种特性使得烷烃很难转化为其他类型的有机分子。(只有几种方法可以做到这一点)。烷烃的密度也低于水,正如人们观察到的那样,油(一种烷烃)漂浮在水上。
烷烃是非极性溶剂。由于只有 C 和 H 原子存在,烷烃是非极性的。烷烃在水中不溶,但在其他非极性溶剂中自由混溶。由弱偶极-偶极键组成的烷烃无法破坏水分子之间的强氢键,因此不溶于水。烯烃也表现出相同的性质。因为烷烃只含有碳和氢,所以燃烧会产生只含有碳、氢和/或氧的化合物。与其他烃类一样,在大多数情况下燃烧主要产生二氧化碳和水。但是,烷烃需要更多的热量才能燃烧,并且在燃烧时释放的热量不如其他类型的烃类多。因此,在与其他烃类在相同温度下燃烧时,烷烃的燃烧会产生更高浓度的含氧有机化合物,如醛和酮。
烷烃的通式为 CNH2N+2;最简单的烷烃是甲烷,CH4。下一个最简单的烷烃是乙烷,C2H6;该系列可以无限延伸。烷烃中每个碳原子都具有 sp³ 杂化。
烷烃也称为石蜡,或统称为石蜡系。这些术语也用于碳原子形成单一、不分支链的烷烃。分支链烷烃称为异石蜡。
甲烷到丁烷在标准温度和压力 (STP) 下是易燃气体。戊烷是一种极易燃的液体,沸点为 36 °C,沸点和熔点从那里开始稳定升高;十八烷是第一个在室温下为固体的烷烃。更长的烷烃是蜡状固体;蜡烛蜡通常含有 C20 到 C25 的链。随着链长的增加,我们最终会得到聚乙烯,它由无限长的碳链组成,通常是硬的白色固体。
烷烃与离子或其他极性物质的反应非常差。所有烷烃的 pKa 值均高于 50,因此它们实际上对酸和碱呈惰性。这种惰性是石蜡(拉丁语 para + affinis,意思是“缺乏亲和力”)一词的来源。在原油中,烷烃分子在数百万年中保持化学不变。
然而,烷烃的氧化还原反应,特别是与氧气和卤素的反应,是可能的,因为碳原子处于强还原状态;以甲烷为例,碳的最低可能氧化态(-4)被达到。与氧气的反应导致燃烧,没有任何烟雾;与卤素反应,发生取代。此外,烷烃已被证明可以与某些过渡金属配合物相互作用并与之结合。
自由基,即具有不成对电子的分子,在大多数烷烃反应中起着重要作用,例如裂解和重整,其中长链烷烃被转化为短链烷烃,直链烷烃被转化为支链异构体。
在高度支化的烷烃和环烷烃中,键角可能与最佳值 (109.5°) 有很大差异,以允许不同的基团有足够的空间。这会导致分子中产生张力,称为空间位阻,并且可以显着提高反应性。烯烃也更喜欢这种结构。
在我们了解有机化学中的反应之前,我们必须首先了解一些关于化合物命名的基本知识。国际纯粹与应用化学联合会 (IUPAC) 命名法 是大多数有机化学家都同意的一个系统,它提供了一些指导方针,使他们能够从彼此的工作中学习。换句话说,命名法为有机化学提供了语言基础。
所有烷烃的名称都以-烷结尾。无论是碳原子首尾相连形成环(称为环状烷烃或环烷烃),还是它们包含侧链和分支,每个碳氢链的名称,只要不含任何双键或官能团,都将在后缀-烷结尾。
具有不分支碳链的烷烃,只需根据链中碳原子的数量来命名。该系列的前四个成员(按碳原子数排序)的名称如下:
- CH4 = 甲烷 = 一个氢饱和的碳
- C2H6 = 乙烷 = 两个氢饱和的碳
- C3H8 = 丙烷 = 三个氢饱和的碳
- C4H10 = 丁烷 = 四个氢饱和的碳
具有五个或更多个碳原子的烷烃,通过在适当的数字乘数后添加后缀-烷来命名,但基本数字词中的-a被删除。因此,C5H12 称为戊烷,C6H14 称为己烷,C7H16 称为庚烷,等等。
直链烷烃有时用前缀n-(代表正)来表示,以区别于具有相同碳原子数的支链烷烃。虽然这不是严格必要的,但在直链和支链异构体之间存在重要性质差异的情况下,这种用法仍然很常见:例如,正己烷是一种神经毒素,而它的支链异构体则不是。
该公式描述了烷烃中氢原子数与碳原子数之间的关系
- H = 2C + 2
其中“C”和“H”用于表示一个分子中存在的碳原子数和氢原子数。如果 C = 2,则 H = 6。
许多教科书将此公式写成以下形式:
- CnH2n+2
其中“Cn”和“H2n+2”表示一个分子中存在的碳原子数和氢原子数。如果 Cn = 3,则 H2n+2 = 2(3) + 2 = 8。(对于此公式,请查看“n”以获得数字,“C”和“H”字母本身不会改变。)
可以制造越来越长的烃链,并根据最长链中碳原子的数量进行系统命名。
- 甲烷 (1 个碳原子)
- 乙烷 (2 个碳原子)
- 丙烷 (3 个碳原子)
- 丁烷 (4 个碳原子)
- 戊烷 (5 个碳原子)
- 己烷 (6 个碳原子)
- 庚烷 (7 个碳原子)
- 辛烷 (8 个碳原子)
- 壬烷 (9 个碳原子)
- 癸烷 (10 个碳原子)
- 十一烷 (11 个碳原子)
- 十二烷 (12 个碳原子)
前三个前缀是德国化学家奥古斯特·威廉·霍夫曼的贡献,他还在 1866 年建议使用 quartane 来表示 4 个碳原子。然而,but- 前缀自 19 世纪 20 年代起就已经在使用,而 quartane 这个名字从未流行起来。他还建议使用元音 a、e、i(或 y)、o 和 u 作为结尾,或者 -ane、-ene、-ine 或 -yne、-one 和 -une。同样,只有前三个被用于单键、双键和三键,而 -one 已经用于酮。Pent、hex、hept、oct 和 dec 都来自古希腊数字(penta、hex、hepta、octa、deka),奇怪的是,non 来自拉丁语 novem。对于更长的烷烃,我们使用特殊的 IUPAC 乘数词缀。例如,十五烷表示具有 5+10 = 15 个碳原子的烷烃。对于长度为 30、40、50 等等的链,基本前缀被添加到 -contane。例如,C57H116 被命名为 heptapentacontane。当链包含 20-29 个原子时,我们有一个例外。C20H42 被称为二十烷,然后我们有,例如,二十四烷(必要时省略“i”)。对于长度为 100,我们有“hecta”,但对于 200、300 ... 900,我们有“dicta”、“tricta”,等等,必要时省略“icta”上的“i”;对于 1000,我们有“kilia”,但对于 2000 等等,我们有“dilia”、“trilia”,等等,必要时省略“ilia”上的“i”。
然后我们将所有前缀按反序排列在一起。具有 9236 个碳原子的烷烃则被称为 hexatridinoniliane。
具有三个以上碳原子的烷烃中的原子可以以多种方式排列,从而导致大量潜在的不同构型(异构体)。所谓的“正”烷烃具有线性、不分支的构型,但任何给定烷烃的n-异构体只是该数量的碳原子和氢原子在某种链状排列中可能存在的数百甚至可能数百万种构型中的一种。
异构体定义为具有相同分子式的化合物,表现出不同分子式排列的化合物被称为异构体。
例如,丁烷的分子式为 C4H10。
异构体的数量随着给定烷烃分子中碳原子数的增加而迅速增加;对于仅含 12 个碳原子的烷烃,该分子可能存在超过 355 种可能的结构!
碳原子数 烷烃的异构体数 1 1 2 1 3 1 4 2 5 3 6 5 7 9 8 18 9 35 10 75 11 159 12 355
碳能够向所有四个方向形成键,并很容易与其他碳原子形成牢固的键。当一个碳原子与两个以上的其他碳原子形成键时,它就会形成一个分支。
 |
 |
上面你可以看到一个碳原子与三个和四个其他碳原子形成键。
- 注意:当一个甲烷基与另一个碳原子而不是第四个氢原子形成键时,它被称为甲基基团。–CH3
常见的系统对碳链的命名规则与它们与分支的关系有关。
- 正烷烃是线性的
- 异烷烃有一个分支 R2CH—
- 新烷烃有两个分支 R3C—
注意:“R”在有机化学中是一个占位符,可以代表任何碳基团。
碳最重要的特性之一是它能够在每个原子中形成多个相对牢固的键。正是由于这个原因,许多科学家认为碳是唯一能够成为支持生命所需的许多复杂分子的基础元素。
一个碳原子不仅可以连接形成单链所需的一个或两个碳,还可以连接多达四个其他碳。正是这种多重键合能力使得异构现象成为可能。
异构体是两种具有相同分子式但物理排列不同的分子。结构异构体的原子排列顺序不同。丁烷的结构异构体的主链在末端分叉,并且其主链比丁烷短一个碳。
 |
 |
有机分子的命名法或命名方法有很多,但主要只有两种。
- 传统的非系统命名法。许多这样的名称仍然存在,特别是对于更简单或更常见的分子。
- 系统的IUPAC(eye-YOU-pack(国际纯粹与应用化学联合会))命名法。
IUPAC 系统对于复杂的有机化合物是必要的。它为命名大型化合物提供了一系列统一规则,通过概念上将化合物细分为更小、更易于管理的命名单元。
许多传统的(非 IUPAC)名称在工业中仍然被普遍使用,尤其是在更简单和更常见的化学品中,因为传统名称早已根深蒂固。
- 找到最长的碳链,确定最靠近 取代基 的末端,并从该末端依次编号碳原子。这将是主链。
- 将所有其他碳基团视为取代基。
- 按字母顺序排列取代基。
- 根据取代基连接的碳原子对其进行编号。如果编号可以以多种方式进行,请使用导致编号最小的编号系统。
取代基的命名类似于母体,将-ane结尾替换为-yl。
上面的分子编号如下
2,3,7-三甲基辛烷
不是 2,6,7-三甲基辛烷。记住,编号是为了给取代基提供最小的编号。
3-乙基-3-甲基戊烷
乙基在按字母顺序排列时位于甲基之前。
3-(1-甲基乙基)-2,4-二甲基戊烷
图中主链编号为 1-5。支链取代基的主体,一个乙基,编号为 1' 和 2'。乙基取代基上的甲基取代基在图中没有编号。
要命名该化合物,将整个支链取代基名称放在括号中,然后像简单取代基一样进行编号和按字母顺序排列。
一些来自常用系统的词缀在 IUPAC 系统中被接受。
为了按字母顺序排列,iso-和neo-被认为是名称的一部分,并按字母顺序排列。Sec-和tert-不被视为名称中可按字母顺序排列的部分。
(在下图中,R-表示任何碳结构。)
异-可以用于在倒数第二个碳处分叉并以两个甲基结尾的取代基。异丁基共有四个碳
仲-可以用于在第一个碳处分叉的取代基。
新-指的是取代基,其链的倒数第二个碳是三取代的(有三个甲基连接到它)。新戊基共有五个碳。
叔-是叔的简称,指的是第一个碳连接有三个其他碳基团的取代基。







