有机化学/手性
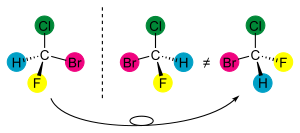
手性(发音为kie-RAL-it-tee)是手性的性质。如果你试图将你的右手叠放在你的左手之上,两者将无法重叠,因为你的右手的拇指会与你的左手的食指重叠。你的两只手无法完全重叠,尽管你每只手的手指以相同的方式连接。任何物体都可以具有这种性质,包括分子。
一个手性物体是一个不能与其镜像重叠的物体。手性物体没有对称平面。非手性物体具有对称平面或旋转反射轴,即反射得到一个旋转后的版本。
旋光异构体或对映异构体是表现出手性的立体异构体。旋光异构体由于其在无机化学、有机化学、物理化学、药理学和生物化学中的应用而备受关注。
它们通常在存在不对称中心时形成,例如,与四个不同基团键合的碳原子。一个对映异构体中的每个立体中心在另一个对映异构体中具有相反的构型。
当一个分子具有多个不对称性来源时,两个旋光异构体可能既不是彼此的完美镜像,也不能重叠:一些但不全是立体中心发生反转。这些分子是非对映异构体的一个例子:它们不是对映异构体。非对映异构体很少具有相同的物理性质。有时,立体中心本身是对称的。这会导致一种反直觉的情况,即可能存在两个手性中心,但没有产生异构体。这种化合物被称为内消旋化合物。
等量的两种对映异构体的混合物被称为外消旋混合物。
是分子的对称性(或任何其他物体)决定了它是否为手性。从技术上讲,如果一个分子只有不正则旋转轴,则它是非手性的(非手性);也就是说,一个n次旋转(旋转360°/n),然后在垂直于该轴的平面上进行反射,该反射将该分子映射到自身。一个手性分子不一定是反对称的(完全没有对称性),因为它可以具有例如旋转对称性。一个简化的规则适用于四面体键合的碳原子,如插图所示:如果所有四个取代基都不同,则该分子为手性。
重要的是要记住,溶解在溶液中或处于气相中的分子通常具有相当大的柔韧性,因此可能采用多种不同的构象。这些不同的构象本身几乎总是手性的。但是,在评估手性时,必须使用对应于一种化学构象的结构图——能量最低的结构图。
最常见的是,手性分子具有点手性,围绕一个单原子,通常是碳原子,该碳原子具有四个不同的取代基。这些化合物的两种对映异构体被称为在这个中心具有不同的绝对构型。因此,该中心是立体成性的(即,可以被认为是立体异构体焦点的分子实体中的一个基团),并且以氨基酸的α-碳原子为例。
碳原子的特殊性质,其形成与不同取代基的四个键,意味着具有四个不同键的碳原子的镜像将不会与原始化合物相同,无论你如何尝试旋转它。理解这一点至关重要,因为有机化学的目标是理解如何使用工具合成具有所需手性的化合物,因为不同的排列可能没有影响,甚至可能具有不良影响。
如果一个碳原子(或其他类型的原子)同时与四个不同的原子或原子链键合,则该碳原子是手性的。最常见的是,这指的是一个碳原子与三个杂原子和一个氢原子键合,或者与两个杂原子以及一个与另一个碳原子的键和一个与氢原子的键键合。它也可以指与四种不同类型的分子键合的氮原子,如果氮原子将它的孤对电子用作亲核试剂。如果氮原子只有三个键,则它不是手性的,因为孤对电子可以自发地从原子的一侧翻转到另一侧。
有机分子中任何与四种不同类型的原子或原子链键合的原子都可以被认为是“手性的”。
如果一个碳原子(或其他类型的原子)具有四个不同的取代基,则该碳原子形成一个手性中心(也称为立体中心)。手性分子通常具有一个或多个立体中心。在绘制分子时,立体中心通常用碳原子附近的星号表示。
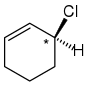
示例
左:该碳原子具有 Cl、Br 和 2 CH3。这只有 3 个不同的取代基,这意味着它不是立体中心。
中心:该碳原子具有一个乙基 (CH2CH3)、一个甲基 (CH3) 和 2 个 H。这不是立体中心。
右:该碳原子具有 Cl 和 1 个 H。然后你需要查看环周围。由于一侧具有双键,而另一侧没有,这意味着该碳原子的取代基是不同的。这 4 个不同的取代基使得该碳成为立体中心,并使该分子成为手性的。
一个分子可以具有多个手性中心,但整体上不一定是手性的:然后它被称为内消旋化合物。如果存在将手性中心联系起来的对称元素(镜面或反转中心),就会发生这种情况。
费歇尔投影(以德国化学家赫尔曼·埃米尔·费歇尔命名)是表示碳原子构型的一种巧妙方法。将碳原子视为中心,朝向观察者的键水平放置。那些远离观察者的键垂直绘制。这个过程,当使用常见的虚线和楔形键表示时,会产生有时被称为“领结”的图,因为它具有其特征形状。这种表示进一步缩写为两条线:水平线(向前)和垂直线(向后),如下面的图所示

- 在费歇尔投影中,交换两个取代基位置会导致立体中心的翻转
- 费歇尔投影旋转 90°会导致翻转
- 费歇尔投影旋转 180°会保留构型
有三种主要系统用于描述构型:最古老的相对构型,其使用现已过时;以及当前的绝对构型。相对构型描述主要仍在糖化学中使用。构型也可以根据旋光性的纯粹经验基础来分配。
旋光异构体可以通过它旋转偏振光平面的方向来命名。如果一个异构体按顺时针方向旋转平面,如朝向光的传播方向的观察者所见,则该异构体标记为 (+)。其对应物标记为 (-)。(+) 和 (-) 异构体也分别被称为 d- 和 l-(代表右旋和左旋)。这种标记很容易与 D- 和 L- 混淆,因此不鼓励使用 IUPAC。
一个对映异构体可以顺时针旋转偏振光(d- 或 +- 对映异构体)的事实与其相对构型(D- 或 L-)无关。
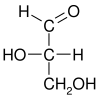
费歇尔的研究兴趣是碳水化合物化学,他以甘油醛(最简单的糖,系统命名为 2,3-二羟基丙醛)为模板手性分子,用 D- 和 L- 表示两种可能的构型,分别使偏振光顺时针和逆时针旋转。

如果可以通过取代从甘油醛正式获得手性中心,则所有其他分子都被分配 D- 或 L- 构型。因此,D- 或 L- 命名方案被称为相对构型。
|
可以通过其原子的空间构型来命名光学异构体。D/L 系统通过将分子与甘油醛相关联来做到这一点。甘油醛本身也是手性的,其两种异构体分别标记为 D 和 L。某些化学操作可以在不影响其构型的情况下对甘油醛进行,并且它在历史上用于此目的(可能与它作为最常用的手性分子之一的便利性相结合)导致了它在命名法中的使用。在这个系统中,化合物是通过类比甘油醛命名的,这通常会产生明确的命名,但最容易在类似于甘油醛的小型生物分子中看到。

一个例子是氨基酸丙氨酸:丙氨酸有两种光学异构体,它们根据它们来自甘油醛的哪种异构体进行标记。甘氨酸,从甘油醛衍生的氨基酸,恰好不保留其光学活性,因为其中心碳不是手性的。然而,丙氨酸本质上是甲基化的甘氨酸,并显示光学活性。
D/L 标记与 (+)/(-) 无关;它不指示哪种对映异构体是右旋的,哪种是左旋的。相反,它表示该化合物的立体化学与甘油醛的右旋或左旋对映异构体的立体化学相关。在蛋白质中常见的 19 种 L- 氨基酸中,有 9 种是右旋的(在 589 纳米的波长下),D- 果糖也被称为左旋糖,因为它也是左旋的。
甘油醛的右旋异构体实际上是 D 异构体,但这是一个幸运的猜测。在建立这个系统的时候,还没有办法确定哪种构型是右旋的。(如果猜测是错误的,那么现在的标记情况会更加混乱。)
确定氨基酸 D/L 异构体形式的经验法则是“CORN”法则。这些基团
- COOH、R、NH2 和 H(其中 R 是未命名的碳链)
围绕手性中心碳原子排列。如果这些基团围绕碳原子顺时针排列,那么它是 L- 型。如果逆时针排列,那么它是 D- 型。此规则仅在氢原子指向页面外时有效。[1]
通过绝对构型:R- 和 S-
[edit | edit source]主要文章:R-S 系统
绝对构型系统源于Cahn-Ingold-Prelog 优先规则,它允许对立体中心进行精确描述,而无需使用任何参考化合物。实际上,其基础现在是立体中心取代基的原子序数。
R/S 系统是另一种通过其构型命名光学异构体的方法,不涉及甘油醛等参考分子。它根据一个系统对每个手性中心进行 R 或 S 标记,该系统根据 Cahn Ingold Prelog 优先规则对每个配体进行优先级分配,基于原子序数。
该系统标记了分子中的每个手性中心(并且也有一个扩展到不涉及手性中心的非手性分子)。因此,它比 D/L 系统更具普遍性,并且可以例如标记 (R,R) 异构体与 (R,S)——非对映异构体。
R/S 系统与 (+)/(-) 系统没有固定关系。R 异构体可以是右旋的,也可以是左旋的,具体取决于其确切的配体。
R/S 系统与 D/L 系统也没有固定关系。例如,甘油醛的配体之一是羟基,-OH。如果将一个硫醇基,-SH,换成它,则根据其定义,D/L 标记不会受到取代的影响。但这种取代将反转分子的 R/S 标记,因为硫的原子序数高于碳,而氧的原子序数低于碳。[注意:这似乎不正确。氧的原子序数高于碳。硫的原子序数高于氧。此示例中优先级分配发生变化的原因是,CH2SH 基团的优先级高于 CHO,而在甘油醛中,CHO 的优先级高于 CH2OH。]
出于这个原因,D/L 系统在某些领域仍然被广泛使用,例如氨基酸和碳水化合物化学。将所有高等生物的常见氨基酸标记为相同的方式很方便。在 D/L 中,它们都是 L。在 R/S 中,它们并非都是 S——大多数都是,但例如半胱氨酸是 R,这又是因为硫的原子序数更高。
术语“外消旋体”源于拉丁语中的葡萄词;该术语起源于路易·巴斯德的工作,他从葡萄酒中分离出外消旋酒石酸。
没有立体中心的非手性化合物
[edit | edit source]一个分子也可以在没有实际点手性(立体中心)的情况下成为手性的。常见的例子包括 1,1'-联-2-萘酚(BINOL)和 1,3-二氯-丙二烯,它们具有轴向手性,以及 (E)-环辛烯,它具有平面手性。
例如,下图所示的异构体是不同的。由于双键旋转的限制,这两个异构体不能自发地相互转换。

其他类型的没有立体中心的非手性化合物(如由于空间位阻导致单键旋转的限制)也存在。考虑以下 R 和 S 联萘分子的例子
如果 X 和 Y 基团引起空间位阻,则联苯 C-C 键无法旋转。
该化合物表现出螺旋手性。
光学异构体的性质
[edit | edit source]对映异构体具有——当存在于对称环境中时——相同的化学和物理性质,除了它们使平面偏振光旋转相同量但方向相反的能力。等量光学活性异构体及其对映异构体的溶液被称为外消旋溶液,它对平面偏振光的净旋转为零。
对映异构体在它们如何与其他化合物的不同光学异构体相互作用方面有所不同。在自然界中,大多数生物化合物(如氨基酸)以单一对映异构体的形式存在。因此,化合物的不同对映异构体可能具有明显不同的生物学效应。相同手性药物的不同对映异构体可能具有非常不同的药理作用,主要是因为它们结合的蛋白质也是手性的。
例如,薄荷叶和孜然籽分别含有 L- 香芹酮和 D- 香芹酮——香芹酮的对映异构体。对于大多数人来说,它们闻起来不同,因为我们的味觉感受器也包含手性分子,它们在存在不同对映异构体时表现不同。

D- 型氨基酸往往尝起来很甜,而 L- 型通常是无味的。这再次归因于我们手性的味觉分子。橙子和柠檬的气味是 D 和 L 对映异构体的例子。
青霉素的活性具有立体选择性。该抗生素仅作用于细菌细胞壁中存在的 D- 丙氨酸的肽键——但在人类中没有。该抗生素只能杀死细菌,而不能杀死我们,因为我们没有这些 D- 氨基酸。
偏振光的电场和磁场在几何平面上振荡。垂直于该平面的轴给出了能量传播的方向。光学活性异构体旋转场振荡的平面。偏振光实际上在外消旋混合物中也被旋转,但它被两种对映异构体之一向左旋转,被另一个向右旋转,它们抵消为零净旋转。
生物学中的手性
[edit | edit source]许多具有生物活性的分子都是手性的,包括天然存在的氨基酸(蛋白质的组成部分)和糖。有趣的是,在生物系统中,大多数这些化合物具有相同的手性:大多数氨基酸是 L,糖是 D。生物学中这种同手性的起源是许多争论的主题。

手性物体与其他手性物体的两种对映异构体具有不同的相互作用。酶是手性的,它们通常区分手性底物的两种对映异构体。想象一下,酶就像一个手套状的空腔,它可以结合底物。如果这个手套是右手的,那么一种对映异构体将适合在里面结合,而另一种对映异构体将很不适合,不太可能结合。

许多配位化合物是手性的;例如,著名的[Ru(2,2'-联吡啶)3]2+配合物,其中三个联吡啶配体采用手性螺旋桨状排列[7]。在这种情况下,Ru原子可以被视为一个手性中心,该配合物具有点手性。[Ru(2,2'-联吡啶)3]2+之类的配合物的两种对映异构体可以分别用Λ(由配体描述的螺旋桨的左旋扭转)和Δ(右旋扭转)表示。六醇是一种手性钴化合物。
- 任何非外消旋手性物质被称为对映体富集
- 当两种可能的对映异构体中只有一种存在时,手性物质称为对映体纯或同手性。
- 当一种对映异构体过量存在,但并非完全排除非另一种对映异构体时,手性物质称为对映体富集或异手性。
- 对映体过量或ee是衡量一种对映异构体与另一种对映异构体的比例。例如,在ee为R的40%的样品中,剩余的60%为外消旋,其中R占30%,S占30%,因此R的总量为70%。
存在多种策略用于制备对映体纯化合物。第一种方法是将外消旋混合物分离成其异构体。路易斯·巴斯德在其开创性工作中能够分离酒石酸的异构体,因为它们从溶液中结晶出来时,形成的对称性不同的晶体。另一种不太常见且最近才发现的方法是通过对映体自歧化,这是一种先进的技术,涉及通过柱色谱分离主要为外消旋的部分和几乎为对映体纯的部分。
在非对称环境(如生物环境)中,对映异构体可能以不同的速度与其他物质反应。这是手性合成的基础,它通过与手性分子反应或用它们催化来保留分子的所需手性,这些手性分子能够在所需构象中维持产物的手性(使用某些手性分子来帮助它保持其构型)。有机化学家还使用其他方法来合成给定反应中仅(或可能只是大部分)所需的对映异构体。
工业化学工艺的进步使制药公司能够将最初以外消旋形式销售的药物分离成单个对映异构体,每个对映异构体可能具有独特的性质。对于某些药物,如佐匹克隆,只有一种对映异构体(左佐匹克隆)具有活性;FDA已经允许这些曾经的通用药物以另一个名称获得专利并上市。在其他情况下,如布洛芬,两种对映异构体产生相同的效果。类固醇受体位点也显示出立体异构体特异性。
外消旋混合物和对映异构体的例子,它们已经被上市销售,包括
- 氧氟沙星(氟哌酸)和左氧氟沙星(乐伐沙星)
- 布比卡因(马卡因)和罗哌卡因(纳洛芬)
- 哌甲酯(利他能)和右旋哌甲酯(专注达)
- 西替利嗪(息斯敏)和左西替利嗪(开瑞坦)
- 沙丁胺醇(喘乐宁)和左沙丁胺醇(舒喘宁)
- 奥美拉唑(洛赛克)和埃索美拉唑(耐信)
- 西酞普兰(赛乐特/希普拉密)和艾司西酞普兰(乐思罗/希普拉克)
- 佐匹克隆(依眠宁)和左佐匹克隆(伦那特)
- 莫达非尼(思诺思)和阿莫达非尼(醒必泰)——莫达非尼中手性中心是硫,而不是碳。
许多手性药物必须以高对映体纯度制备,因为其他对映异构体可能存在潜在的副作用。(另一个对映异构体也可能仅仅是无活性的。)
考虑外消旋的沙利度胺样品。一种对映异构体被认为对治疗妊娠呕吐有效,而另一种现在已知具有致畸作用。不幸的是,在这种情况下,仅仅给孕妇服用一种对映异构体仍然非常危险,因为两种对映异构体在体内很容易相互转换。因此,如果一个人服用任何一种对映异构体,D和L异构体最终都将存在于患者的血清中,因此化学过程可能无法减轻其毒性。