有机化学/手性/非对映异构体
非对映异构体是立体异构体,它们不是彼此的对映异构体(镜像)。由于它们的形状不同,非对映异构体可能具有不同的物理和化学性质。对于生物系统中涉及的非对映异构体,这可能尤其如此。
根据 IUPAC,术语“几何异构”是“顺反异构”的过时同义词,强烈建议不要使用。有时,“几何异构”一词已被用作立体异构的同义词,即光学异构体被认为是几何异构体。但是,这与当前标准化学命名法不一致。对于不是光学异构体的立体异构体的精确术语是非对映异构体。
非对映异构体的一种特殊类型是差向异构体。差向异构体是在多个不对称碳原子中仅在一个不对称碳原子处不同的非对映异构体。还有一种叫做端基异构体的东西,它是一种特殊的差向异构体。端基异构体是在形成环时(在碳水化合物化学中)在一个新的不对称碳原子处不同的差向异构体。
当存在双键时,可能会发生立体异构,因为涉及的π键阻止该键以与单键相同的方式“扭曲”。一个很好的例子是 1,2-二氯乙烯:C2H2Cl2。考虑以下两个例子
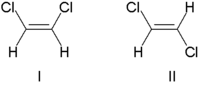
上面显示的两个分子是顺-1,2-二氯乙烯和反-1,2-二氯乙烯。这两个分子是几何异构体,因为由于它们之间π键引起的刚性,两个碳原子不能彼此旋转。因此,它们不是“可重叠的” - 它们不相同,也不能互相取代。顺/反异构体具有不同的化学和物理性质,并且可能表现出截然不同的生物活性。
顺反异构(通常称为几何异构,尽管此术语是指所有立体异构体)是立体异构的一种形式,它描述了键两端的官能团的取向,该键周围没有旋转。烯烃和环烷烃都限制了某些键周围的旋转。在烯烃中,双键限制了运动和旋转,环烷烃的环状结构也是如此。
烯烃双键周围可以旋转,但这需要 60 到 70 千卡的能量。如果不添加这种能量,从双键一侧开始的基团就会停留在那里。这就是顺/反异构的基础。
有两种形式;顺式和反式异构体。取代氢原子位于不允许旋转的键的同一侧的形式称为顺式;取代氢原子位于键的相对侧的形式称为反式。显示顺反异构的小烃的一个例子是 2-丁烯。
物质的顺式异构体和反式异构体具有不同的物理性质。反式异构体通常具有更高的沸点和更低的密度。这是因为反式异构体分子比顺式异构体分子更容易排列和相互配合。两种具有截然不同性质的异构体是马来酸和富马酸。这些名称是 2-丁烯二酸的两个普通名称,分别是顺式和反式异构体。
环烷烃和类似的化合物也可以表现出顺反异构。作为由于环状结构而导致的几何异构体的例子,请考虑 1,2-二氯环己烷。这些化合物可以使用R/S 命名法更严格地命名。

|

|
| 顺-1,2-二氯环己烷 | 反-1,2-二氯环己烷 |
| 1(R),2(S)-二氯环己烷 | 1(S),2(S)-二氯环己烷 |
主条目:E-Z 系统
当双键上有两个以上不同的取代基时,用于命名异构体的反式/顺式系统会失效。(顺/反系统只能在所涉及的碳原子都连接有氢原子的情况下使用)。E/Z 命名法是不含糊的。Z(来自德语zusammen)意为“一起”,通常对应于术语顺式;E(来自德语entgegen)意为“相对”,通常对应于术语反式。
通常,E 异构体比 Z 异构体更稳定,因为存在空间效应。当两个大的基团彼此更靠近时,就像它们在 Z 中经常出现的那样,它们彼此干扰更多,并且比在 E 中具有更高的势能,在 E 中,大的基团距离更远,彼此干扰更少。
简单来说,如果只有一个手性中心在两个立体异构体之间不同,则两个立体异构体是彼此的非对映异构体。也就是说,如果两个分子都包含两个或多个手性中心,但如果每个分子中只有一个手性中心不同于另一个,则这两个分子是彼此的非对映异构体。
如果一个分子包含一个不对称碳原子或立体中心,它将具有两种镜像形式。如果一个分子包含两个不对称碳原子,则有四种可能的构型,从数学和物理上来说,所有四种构型都无法彼此为镜像。分子中手性中心越多,不同构象异构体的可能性就越多,因此可能存在的非对映异构体就越多。
例如,酒石酸包含两个不对称中心,但酒石酸分子的两种构型彼此等效 - 它们统称为内消旋化合物。这种构型没有光学活性,而其余两种构型是D- 和L- 镜像。因此,酒石酸的内消旋形式是其他形式的非对映异构体。

|

| |
|
(天然)酒石酸 |
D-(-)-酒石酸 |
内消旋酒石酸 |
|
(1:1) |
||
用于区分非对映异构体的两个常用前缀是苏式和赤式。当以费歇尔投影式绘制时,赤式异构体在同一侧具有两个相同的取代基,而苏式异构体在相对侧具有两个相同的取代基。
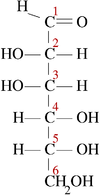
5 碳和 6 碳碳水化合物家族包含许多非对映异构体,因为这些分子中存在大量不对称中心。由于醛糖(一种类型的碳水化合物)的主链中的每个碳以及酮糖(另一种类型的碳水化合物)的主链中除一个碳以外的所有碳都连接有氢和羟基,因此任何给定糖中的大多数碳实际上都是手性的。由于手性分子的可能构象数量是 2 的n 次方(2n),其中n 是手性中心的个数,这使得碳水化合物具有很大的变异性,并且存在大量的非对映异构体。

|

|

|
|
| D-葡萄糖 | L-葡萄糖 | D-半乳糖 | D-甘露糖 |
葡萄糖在溶液中采用环状结构。这对于费歇尔投影式来说非常尴尬,因此通常使用霍沃思投影式来代替
费歇尔投影式右侧的 -OH 基团在霍沃思投影式中绘制在环下方。
非对映选择性是指在一个有机反应中,一种或多种非对映异构体比另一种更优先形成。





