生物化学原理/碳水化合物:单糖、二糖和多糖
| 此页面已导入,需要进行去维基化. 书籍应该谨慎使用维基链接,并且只用于引用理解内容至关重要的技术或深奥术语。大多数维基链接甚至全部都应该删除。请在页面去维基化后删除 {{dewikify}}。 |
早些时候,化学中使用“碳水化合物”这个名称来指代任何具有Cm(H2O)n 化学式的化合物。根据此定义,一些化学家认为甲醛CH2O是最简单的碳水化合物,
而另一些人则认为羟基乙醛具有此称号。如今,该术语通常在生物化学意义上理解,其排除了仅包含一个或两个碳原子的化合物。天然糖类通常由称为单糖的简单碳水化合物构成,其通式为 (CH2O)n,其中n 为 3 或更大。典型的单糖具有结构 H-(CHOH)x(C=O)-(CHOH)y-H,即含有多个羟基基团的醛或酮,通常每个碳原子都带有一个羟基,但不包括醛或酮的官能团。单糖的例子包括葡萄糖、果糖和甘油醛。然而,一些通常被称为“单糖”的生物物质不符合此公式(例如,糖醛酸和脱氧糖,如岩藻糖),并且许多化学物质符合此公式,但不被认为是单糖(例如,甲醛 CH2O 和肌醇 (CH2O)6)。单糖的开链形式通常与杂环化合物|闭环形式共存,其中醛/酮羰基碳 (C=O) 和羟基 (-OH) 发生反应,形成半缩醛,并产生新的 C-O-C 键。单糖可以通过多种方式连接在一起形成多糖(或寡糖)。许多碳水化合物包含一个或多个修饰的单糖单元,这些单元已经替换或去除了一个或多个基团。例如,脱氧核糖是 DNA 的组成部分,是核糖的修饰版本;几丁质由重复的 N-乙酰葡萄糖胺单元组成,N-乙酰葡萄糖胺是葡萄糖的含氮形式。[1]
单糖构象:吡喃糖和呋喃糖形式可以以不同的构象体形式存在,并且如果满足能量代价,则可以相互转换。对于呋喃糖体系,存在两种可能的构象体:扭曲 (T) 和包络 (E)。在吡喃糖体系中,可能存在四种构象体:椅式 (C)、船式 (B)、斜式 (S)、半椅式 (H) 或包络式 (E)。在所有情况下,至少有四个或更多个原子构成一个平面。为了定义哪些原子位于平面上方或下方,必须使分子方向,以便从顶部看时,原子按顺时针方向编号。位于平面上的原子以 a 上标为前缀,位于平面下的原子以 a 下标为后缀。如果环氧原子位于平面之上或之下,则必须适当地添加前缀或后缀。
构象分析 六元环的椅式构象在相邻取代基之间具有 60° 的二面角,因此使其成为最稳定的构象体。由于存在两种可能的椅式构象,因此在查看相对能量时,必须考虑立体和立体电子效应,例如异头体效应、1,3-二轴相互作用、偶极子和分子内氢键。具有 1,3-二轴相互作用的构象通常由于空间位阻而受到不利影响,并且可以将平衡转移到另一个椅式形式(例如:1C4 到 4C1)。取代基的大小极大地影响了这种平衡。但是,分子内氢键可以作为 1,3-二轴相互作用的稳定例子。偶极子也影响构象体的稳定性,排列的偶极子会导致能量增加,而相反的偶极子会导致能量降低,从而产生稳定效应,这会因溶剂效应而变得复杂。极性溶剂往往会稳定排列的偶极子。在确定首选构象时,必须考虑所有相互作用。五元环的构象仅限于两种,包络式和扭曲式。包络式构象具有四个原子在一个平面上,而扭曲式构象仅具有三个原子在一个平面上。在包络式中,可以设想两种不同的情况;一种是环氧原子位于四个原子平面内,另一种是环氧原子位于平面之上或之下。当环氧原子不在平面内时,取代基发生重叠,而当它位于平面内时,扭转应变得以缓解。扭曲式的构象分析类似,因此导致两种形式的能量非常接近。[2]
异头体是糖苷、半缩醛或糖类的相关环状形式,或相关分子在其构型上仅在 C-1 位置上不同的非对映异构体。当第一个碳的立体化学与最后一个立体异构中心的立体化学一致时,糖是 α-异头体;当它们相反时,糖是 β-异头体。在有机化学中,异头体效应或爱德华-勒米厄效应是一种立体电子效应,它描述了在环己烷环中与杂原子相邻的杂原子取代基的倾向,其优先选择轴向取向,而不是从空间考虑角度来看,不太受阻的赤道取向。这种效应最初是在 1955 年由 J. T. 爱德华在吡喃糖环中观察到的;当时,N.-J. Chii 和 R. U. 勒米厄开始研究几种醛糖吡喃糖的全乙酰化衍生物的异构化平衡。术语“异头体效应”在 1958 年提出。异头体效应的名称源于用于指定吡喃糖的 C-1 碳的术语,即异头体碳。仅在异头体碳的构型上不同的异构体称为异头体。[3]
吡喃葡萄糖的异构体是差向异构体,其中右侧的β异构体在图的右下角有一个指向赤道方向的OH基团,而左侧的α异构体则有一个指向轴向方向的OH基团。 异构体效应可以推广到任何具有通式R-Y-C-Z的体系,其中Y是具有一个或多个电子孤对的原子,而Z是电负性原子。 以糖为例,异构体效应的强度估计为大约1-2 kcal/mol。 在这种一般情况下,分子不必是环状的。 例如,二甲氧基甲烷是一种经常用于理论研究的小分子,它表现出异构体效应。 在二甲氧基乙烷的情况下,顺式-顺式构象的能量比反式-反式构象低约3-5 kcal/mol(更稳定)——这大约是糖中效应的两倍,因为有两个旋转键受到影响。[4]
异构体效应
异构体可以通过一个称为变旋现象的过程相互转化。 异构体效应更准确地称为内异构体效应,是指C-1上的杂原子倾向于轴向排列。 这与直觉相悖,因为人们会认为赤道异构体应该是热力学产物。 这种效应已经通过偶极-偶极排斥和n-σ*论证得到了解释。[5]
反异构体效应
反异构体效应是由R. U. Lemieux在1965年提出的,是指异构体位置上的正电性基团倾向于赤道排列。 原始出版物报道了这种现象与N-(2,3,4,6-四-O-乙酰基-α-D-吡喃葡萄糖基)-4-甲基吡啶鎓溴化物有关。 然而,进一步的研究表明这种效应是溶剂化和空间位阻问题。 人们普遍认为不存在广义的反异构体效应。[6]
羟甲基构象
C-5/C-6键的旋转由角度ω描述。 有三种可能的交错构象:顺式-反式 (gt)、顺式-顺式 (gg)、反式-顺式(tg)。 该名称表示O-5与OH-6之间的相互作用,然后是OH-6与C-4之间的相互作用。[7]
 |

|
|
| |
 |

|
|
|
寡糖构象
[edit | edit source]除了影响单糖残基的因素外,寡糖和多糖的构象分析还需要考虑其他因素。
外异构体效应 外异构体效应与内异构体效应类似。 区别在于,提供的孤对来自C-1上的取代基。 然而,由于取代基可以是轴向或赤道排列,因此存在两种类型的外异构体效应,一种来自轴向糖苷,另一种来自赤道糖苷,只要供体轨道与受体轨道反式平行。
糖苷扭转角
三个角度由φ、ψ和ω(在通过O-6形成糖苷键的情况下)描述。 在观察首选角度时,需要考虑空间位阻和异构体效应。
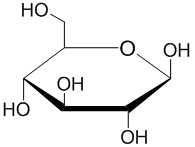
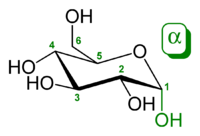
α-D-吡喃葡萄糖 吡喃糖是一个总称,用于指包含一个六元环的碳水化合物,该六元环由五个碳原子和一个氧原子组成。 这个名字来源于它与氧杂环吡喃的相似性,但吡喃糖环没有双键。 一个吡喃糖,其中C(1)上的异构体OH已被转化为OR基团,被称为吡喃糖苷。[8]
吡喃糖的形成 吡喃糖环是由糖中碳 5 (C-5) 上的羟基与碳 1 上的醛基反应形成的。 这样就形成了一个分子内半缩醛。 如果C-4羟基与醛基之间发生反应,就会形成一个呋喃糖。
吡喃糖半缩醛的形成和β-D-吡喃葡萄糖的表示 β-D-吡喃葡萄糖的霍沃斯投影 赫尔曼·埃米尔·费歇尔因其在确定D-醛糖结构方面的贡献获得了1902年的诺贝尔化学奖。 然而,费歇尔提出的线性、游离醛结构在溶液中仅占己糖形式的极小比例。 是埃德蒙·赫斯特和克利福德·珀维斯在沃尔特·霍沃斯的研究小组中,最终确定己糖优先形成吡喃糖,或六元环。 霍沃斯将该环绘制成一个扁平的六边形,环平面以上和以下都有基团——这就是霍沃斯投影。
对吡喃糖环构象的进一步完善来自斯蓬斯勒和多尔(1926年),他们意识到萨赫斯的六元环数学处理方法可以应用于他们对X射线结构的纤维素的分析。 确定吡喃糖环是褶皱的,以使环中的所有碳原子都能接近理想的四面体几何形状。
吡喃糖环的构象[9]
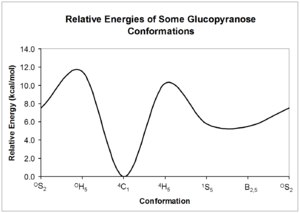
这种褶皱导致了总共38种不同的基本吡喃糖构象:2个椅式、6个船式、6个扭曲船式、12个半椅式和12个信封式。[10]
β-D-吡喃葡萄糖构象异构体的相对能量 这些构象异构体可以相互转化; 然而,每种形式的相对能量可能非常不同,因此可能存在显著的相互转化势垒。 这些构象的能量可以通过量子力学计算得到; 给出了可能的吡喃葡萄糖相互转化的一个例子。[11]
吡喃糖环的构象与环己烷环的构象表面上相似。 然而,吡喃糖的具体命名法包括对环氧的参考,环上的羟基的存在对其构象偏好有明显的影响。 吡喃糖环也存在着特定的构象和立体化学效应。
吡喃糖环的命名法[12]
要命名吡喃糖的构象,首先要确定构象异构体。 常见的构象异构体与环己烷中发现的构象异构体相似,这些构象异构体构成了名称的基础。 常见的构象异构体是椅式 (C)、船式 (B)、扭曲式 (S)、半椅式 (H) 或信封式 (E)。 然后对环原子进行编号; 异构体,或半缩醛,碳原子始终为1。 结构中的氧原子通常用它们在无环形式中所连接的碳原子来表示,并指定为O。 然后
- 将环定位,以便从上面看,原子以顺时针方向编号。 4(或5,在信封的情况下)个原子在一个平面上
- 平面以上的原子在构象异构体标签之前写成上标
- 平面以下的原子在构象异构体标签之后写成下标
单糖
[edit | edit source]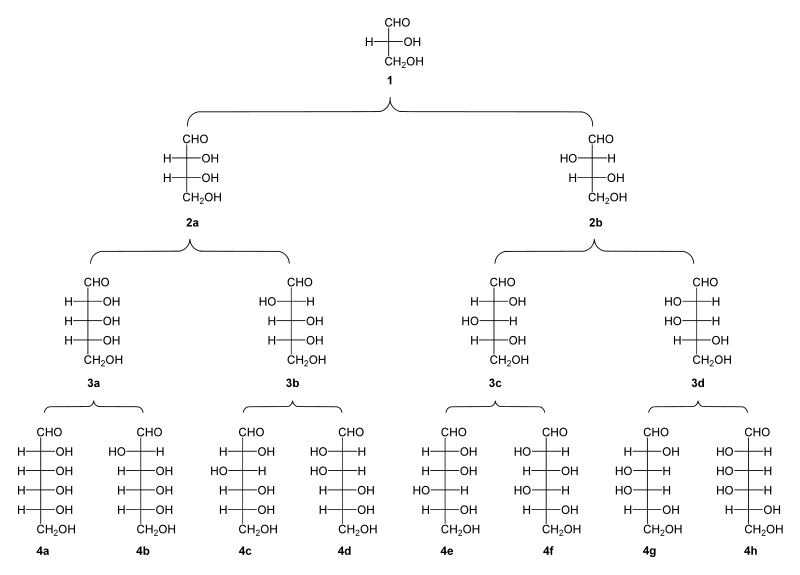
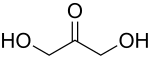
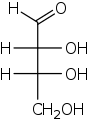
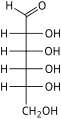
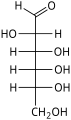
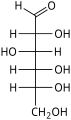
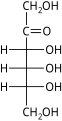
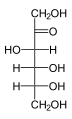
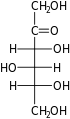
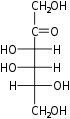
单糖是最简单的碳水化合物,因为它们不能水解成更小的碳水化合物。 它们是含有两个或多个羟基的醛或酮。 未修饰单糖的一般化学式为 (C•H2O)n,实际上是“碳水化合物”。 单糖是重要的燃料分子,也是核酸的组成部分。 最小的单糖,其中n = 3,是二羟基丙酮和D-和L-甘油醛。

三糖
三糖是一种含有三个碳原子的单糖。 只有两种三糖,一种是醛三糖(甘油醛),另一种是酮三糖(二羟基丙酮)。 三糖在呼吸作用中很重要。 具体来说,乳酸和丙酮酸分别来自醛三糖和酮三糖。[14] D-醛三糖是D-甘油醛
酮三糖是二羟基丙酮
四糖
四碳糖是一种含有 4 个碳原子的单糖。它们在第 1 位具有醛基官能团(醛糖)或在第 2 位具有酮基官能团(酮糖)。醛糖有两个手性中心(“不对称碳原子”),因此可能有 4 种不同的立体异构体。自然界中有两种立体异构体,赤藓糖和苏糖的对映异构体具有 D 型构型,但不具有 L 型对映异构体。酮糖有一个手性中心,因此有两种可能的立体异构体:赤藓酮糖(L 型和 D 型)。同样,只有 D 型对映异构体是自然界中存在的。[15]
-
D-赤藓糖
-
D-苏糖
-
D-赤藓酮糖
戊糖
戊糖是一种含有五个碳原子的单糖。戊糖分为两类。醛戊糖在第 1 位具有醛基官能团。酮戊糖在第 2 位或第 3 位具有酮基官能团。这些碳水化合物中的醛基和酮基官能团与相邻的羟基官能团反应,分别形成分子内半缩醛和半缩酮。所得环状结构与呋喃相关,称为呋喃糖。该环自发打开和闭合,允许羰基与相邻碳原子之间的键发生旋转,从而产生两种不同的构型(α 和 β)。这个过程称为变旋。核糖是 RNA 的组成部分,而脱氧核糖是 DNA 的组成部分。由戊糖组成的聚合物称为戊聚糖。[16]
醛戊糖 醛戊糖有三个手性中心,因此可能存在八种不同的立体异构体。
 D-阿拉伯糖 |
 D-来苏糖 |
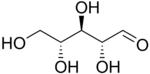 D-核糖 |
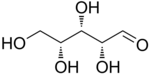 D-木糖 |
 L-阿拉伯糖 |
 L-来苏糖 |
 L-核糖 |
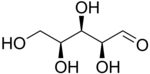 L-木糖 |
酮戊糖 2-酮戊糖有两个手性中心,因此有四种不同的立体异构体。3-酮戊糖很少见。
 D-核酮糖 |
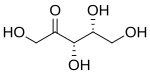 D-木酮糖 |
| File:L-Ribulose.svg L-核酮糖 |
 L-木酮糖 |
己糖 在生物化学中,己糖是一种含有六个碳原子的单糖,化学式为 C6H12O6。己糖根据官能团进行分类,醛糖在第 1 位具有醛基,而酮糖在第 2 位具有酮基。[17]
醛糖 醛糖有四个手性中心,总共有 16 种可能的醛糖立体异构体(24)。D/L 构型基于第 5 位羟基的取向,并不指代旋光性的方向。八种 D-醛糖是[18]
在这些 D-异构体中,除 D-阿卓糖 外,其余都是自然界中存在的。然而,L-阿卓糖是从毛螺菌属纤维溶解菌 菌株中分离出来的。
一个用来记忆己糖的经典口诀是“All atruists gladly make gum in gallon tank”(所有利他主义者都乐意在加仑的油箱里做口香糖)。
环状半缩醛 自 1926 年以来,人们就知道 6 碳醛糖会形成环状半缩醛。[19] 下图显示了 D-葡萄糖和 D-甘露糖的半缩醛形式。
开链形式中的编号碳与半缩醛形式中的相同编号碳相对应。半缩醛的形成导致第 1 号碳在开链形式中是对称的,而在环状形式中则变成不对称的。这意味着葡萄糖和甘露糖(以及所有其他醛糖)都具有两种环状形式。在溶液中,这两种形式都与开链形式处于平衡状态。然而,开链形式不会结晶。因此,两种环状形式在结晶时可以分离。例如,D-葡萄糖形成的 α 型晶体具有旋光度 +112° 和熔点 146 °C,以及 β 型晶体具有旋光度 +19° 和熔点 150 °C。[19][20]
酮糖 酮糖 有 3 个手性中心,因此有八种可能的立体异构体(23)。其中,只有四种 D-异构体已知自然存在:[21]
只有自然界中存在的己糖能够被酵母发酵。
变旋:这些碳水化合物中的醛基和酮基官能团与相邻的羟基官能团反应,分别形成分子内半缩醛和半缩酮。所得环状结构与吡喃相关,称为吡喃糖。该环自发打开和闭合,允许羰基与相邻碳原子之间的键发生旋转,从而产生两种不同的构型(α 和 β)。这个过程称为变旋。己糖可以通过缩合反应形成二己糖,形成 1,6-糖苷键。[22]
庚糖 庚糖是一种含有七个碳原子的单糖。它们在第 1 位具有醛基官能团(醛庚糖)或在第 2 位具有酮基官能团(酮庚糖)。自然界中 C-7 糖的例子很少,其中包括[23]
景天庚酮糖或 D-阿卓庚酮糖(一种酮糖)
甘露庚酮糖,存在于鳄梨中
L-甘油-D-甘露庚糖(一种醛糖)。
酮庚糖有 4 个手性中心,而醛庚糖有 5 个[24]。
什么是豪沃斯投影式?
[edit | edit source]
单糖环状形式的三维结构通常用豪沃斯投影式来表示。在该图中,α-异构体的异头碳的 OH- 在碳原子平面的下方,而 β-异构体的异头碳的 OH- 在平面的上方。吡喃糖通常采用椅式构象,类似于环己烷。在这种构象中,α-异构体的异头碳的 OH- 处于轴向位置,而 β-异构体的异头碳的 OH- 处于赤道位置。[25]
 |
 |
什么是变旋现象? 变旋现象是指由于差向异构(即两个差向异构体之间平衡的变化,当相应的立体异构中心相互转化时)引起的旋光度变化。环状糖会表现出变旋现象,因为 α 和 β异头形式会相互转化。[26]
溶液的旋光度取决于每种异头的旋光度及其在溶液中的比例。
变旋现象由奥古斯丁-皮埃尔·杜布朗福在 1846 年发现,当时他注意到水溶液中糖的比旋光度随时间变化。[27][28]
测量
α 和 β 异头形式的相互转化 α 和 β 异头形式是彼此的非对映异构体,通常具有不同的比旋光度。纯 α 异头的溶液或液体样品将以不同量和/或与该化合物的纯 β 异头相反的方向旋转偏振光。溶液的旋光度取决于每种异头的旋光度及其在溶液中的比例。
例如,如果将 β-D-吡喃葡萄糖溶液溶解在水中,其比旋光度将为 +18.7。随着时间的推移,一些 β-D-吡喃葡萄糖将发生变旋现象,变成 α-D-吡喃葡萄糖,其旋光度为 +112.2。因此,溶液的旋光度将从 +18.7 增加到 +52.5 的平衡值,因为一些 β 型被转化为 α 型。平衡混合物实际上约为 64% 的 β-D-吡喃葡萄糖和约 36% 的 α-D-吡喃葡萄糖,尽管也存在其他形式的微量,包括呋喃糖和开链形式。[29]
样品的观察到的旋光度是每种异头的旋光度的加权和,加权系数为该异头存在的量。因此,只要知道每种纯异头的旋光度,就可以使用旋光仪测量样品的旋光度,然后从对映体过量计算出存在的两种异头的比例。可以监测变旋过程随时间的变化,或通过观察旋光度及其变化来确定平衡混合物。
环状异构体
[edit | edit source]单糖通常通过羰基与同一分子中一个羟基之间的亲核加成反应,从无环(开链)形式转换为环状形式。该反应产生一个由一个桥接氧原子封闭的碳原子环。生成的分子具有半缩醛或半缩酮基团,具体取决于线性形式是醛糖还是酮糖。该反应很容易逆转,生成原始的开链形式。在这些环状形式中,环通常具有 5 或 6 个原子。这些形式分别被称为呋喃糖和吡喃糖——类比于呋喃和吡喃,它们是最简单的具有相同碳氧环的化合物(尽管它们缺乏这两个分子的双键)。例如,醛己糖葡萄糖可以在碳 1 上的羟基和碳 4 上的氧原子之间形成半缩醛键,生成一个具有 5 元环的分子,称为呋喃葡萄糖。相同的反应可以在碳 1 和 5 之间发生,形成一个具有 6 元环的分子,称为吡喃葡萄糖。具有 7 原子环(与氧杂环庚烷相同)的环状形式很少遇到,被称为七碳糖。对于许多单糖(包括葡萄糖),环状形式在固态和溶液中占主导地位,因此通常对开链和闭链异构体使用相同的名称。因此,例如,“葡萄糖”一词可能表示呋喃葡萄糖、吡喃葡萄糖、开链形式或三者的混合物。环化在羰基碳处产生一个新的手性中心。取代羰基氧的-OH 基团最终可能相对于环的中平面处于两个不同的位置。因此,每个开链单糖生成两种环状异构体(异头体),用前缀“α-”和“β-”表示。该分子可以通过称为变旋现象的过程在这两种形式之间变化,变旋现象包括环形成反应的逆转,然后是另一个环形成。[30]



二糖
[edit | edit source]二糖有两种类型:还原性二糖,其中一种单糖,还原性糖,仍然有一个游离的半缩醛单元;和非还原性二糖,其中组分通过其异头中心的缩醛键连接,并且没有一个单糖具有游离的半缩醛单元。纤维二糖和麦芽糖是还原性二糖的例子。蔗糖和海藻糖是非还原性二糖的例子。形成[31]
当两个单糖连接在一起并移除一个水分子时,就会形成二糖。例如:乳糖(乳糖)是由葡萄糖和半乳糖构成的,而甘蔗和甜菜中的糖(蔗糖)是由葡萄糖和果糖构成的。这两个单糖通过脱水反应(也称为缩合反应或脱水合成)连接,导致一个水分子损失并形成糖苷键。[32]
特性
糖苷键可以在组分单糖的任何羟基之间形成。因此,即使两个组分糖相同(例如葡萄糖),不同的键组合(区域化学)和立体化学(α-或β-)也会导致二糖成为非对映异构体,具有不同的化学和物理性质。根据单糖成分,二糖有时呈结晶状,有时可溶于水,有时味道甜美,感觉粘稠。[33]
最常见的二糖 [34]
[edit | edit source]
| 二糖 | 单元 1 | 单元 2 | 键 |
蔗糖(食糖、甘蔗糖、甜菜糖或蔗糖) |
葡萄糖 | 果糖 | α(1→2) |
| 乳果糖 | 半乳糖 | 果糖 | β(1→4) |
乳糖(乳糖) |
半乳糖 | 葡萄糖 | β(1→4) |
| 麦芽糖 | 葡萄糖 | 葡萄糖 | α(1→4) |
| 海藻糖 | 葡萄糖 | 葡萄糖 | α(1→1)α |
| 纤维二糖 | 葡萄糖 | 葡萄糖 | β(1→4) |
蔗糖是通常被称为食糖的有机化合物,有时也被称为蔗糖。它是一种白色无味结晶粉末,味道甜美,最出名的是它在人类营养中的作用。该分子是一种由葡萄糖和果糖衍生的二糖,分子式为 C12H22O11。每年大约生产 1.5 亿吨(公吨)。
乳果糖是一种用于治疗便秘[1] 和肝性脑病(肝病的并发症)的合成糖。它是一种由一分子果糖和半乳糖单糖(单糖)组成的二糖(双糖)。用于治疗便秘的商业糖浆被染成黄橙色。它是通过乳糖异构化工业化生产的。
乳糖于 1619 年由法布里奇奥·巴托莱蒂在牛奶中发现,并于 1780 年由卡尔·威廉·谢勒鉴定为一种糖。乳糖是一种二糖糖,最常见于牛奶中,由半乳糖和葡萄糖构成。乳糖约占牛奶的 2~8%(按重量计),尽管含量因物种和个体而异。它从甜或酸乳清中提取。这个名称来自拉丁语中的 lac,意思是牛奶,加上用于命名糖的 -ose 后缀。它的化学式为 C12H22O11。
麦芽糖(英语发音:/ˈmɒltoʊz/),或麦芽糖,是一种由两个葡萄糖单元通过 α(1→4) 键连接而成的二糖。异构体“异麦芽糖”有两个通过 α(1→6) 键连接的葡萄糖分子。麦芽糖是重要的生物化学葡萄糖链系列中的第二个成员。麦芽糖是淀粉酶分解淀粉时产生的二糖。它存在于发芽的种子(如大麦)中,因为它们分解淀粉储备以用作食物。添加另一个葡萄糖单元会产生麦芽三糖;进一步添加会产生糊精(也称为麦芽糊精),最终会产生淀粉(葡萄糖聚合物)。麦芽糖可以通过水解分解成两个葡萄糖分子。在活生物体中,麦芽糖酶可以非常快速地实现这一点。在实验室中,用强酸加热几分钟将产生相同的结果。异麦芽糖被异麦芽糖酶分解。从发芽的谷物(如大麦)中生产麦芽糖是酿造过程中的重要组成部分。当大麦被麦芽化时,它会被带入一种状态,在这种状态下,产生麦芽糖的淀粉酶的浓度被最大化。糖化是指这些淀粉酶将谷物的淀粉转化为麦芽糖的过程。酵母在发酵过程中对麦芽糖的代谢会导致乙醇和二氧化碳的产生。[35]
海藻糖,也称为麦芽糖或海藻糖,是一种天然的α-连接二糖,由两个α-葡萄糖单元之间形成的α,α-1,1-葡糖苷键构成。 1832年,H.A.L. Wiggers 在黑麦麦角中发现了海藻糖,1859年,Marcellin Berthelot 从海藻糖甘露醇中分离出来,并将其命名为海藻糖。 它可以由真菌、植物和无脊椎动物合成。 它与脱水生物有关——植物和动物抵抗长时间脱水的能力。 它具有很高的保水能力,被用在食品和化妆品中。 这种糖被认为在细胞脱水时会形成凝胶相,这可以防止内部细胞器破坏,有效地将其固定在原位。 然后,再水化使正常的细胞活动恢复,而不会发生通常在脱水/再水化循环后发生的重大致命损伤。 海藻糖具有抗氧化剂的额外优点。 提取海藻糖曾经是一个困难且昂贵的过程,但最近,林原株式会社(日本冈山)确认了从淀粉中廉价提取海藻糖用于大规模生产的技术。 海藻糖目前正在广泛应用中使用。[36]
纤维二糖是一种二糖,化学式为[HOCH2CHO(CHOH)3]2O。 该分子衍生自两个通过β(1→4)键连接的葡萄糖分子缩合而成。 它可以被细菌或阳离子离子交换树脂水解生成葡萄糖。 纤维二糖有八个游离的醇(COH)基团和三个醚键,这会导致强烈的分子间和分子内氢键。 它可以通过对纤维素和富含纤维素的材料(如棉花、黄麻或纸张)进行酶解或酸解得到。 纤维素是通过β(1→4)键连接的葡萄糖单元的聚合物。 用乙酸酐和硫酸处理纤维素,得到纤维二糖八乙酸酯,它不能参与氢键,并且可溶于非极性有机溶剂。[37]
麦芽糖和纤维二糖分别是多糖淀粉和纤维素的水解产物。
不太常见的二糖包括[38]
| 二糖 | 单元 | 键 |
| 异麦芽糖 | 两个葡萄糖单体 | α(1→2)[39] |
| 奈吉罗糖 | 两个葡萄糖单体 | α(1→3) |
| 异麦芽糖 | 两个葡萄糖单体 | α(1→6) |
| β,β-海藻糖 | 两个葡萄糖单体 | β(1→1)β |
| α,β-海藻糖 | 两个葡萄糖单体 | α(1→1)β[40] |
| 槐糖 | 两个葡萄糖单体 | β(1→2) |
| 层板多糖 | 两个葡萄糖单体 | β(1→3) |
| 龙胆二糖 | 两个葡萄糖单体 | β(1→6) |
| 松三糖 | 一个葡萄糖单体和一个果糖单体 | α(1→3) |
| 麦芽酮糖 | 一个葡萄糖单体和一个果糖单体 | α(1→4) |
| 帕拉替诺糖 | 一个葡萄糖单体和一个果糖单体 | α(1→6) |
| 龙胆二糖 | 一个葡萄糖单体和一个果糖单体 | β(1→6) |
| 甘露二糖 | 两个甘露糖单体 | α(1→2)、α(1→3)、α(1→4) 或 α(1→6) |
| 蜜二糖 | 一个半乳糖单体和一个葡萄糖单体 | α(1→6) |
| 蜜二糖 | 一个半乳糖单体和一个果糖单体 | α(1→6) |
| 芸香糖 | 一个鼠李糖单体和一个葡萄糖单体 | α(1→6) |
| 芸香酮糖 | 一个鼠李糖单体和一个果糖单体 | β(1→6) |
| 木二糖 | 两个木吡喃糖单体 | β(1→4) |
| 樱草糖 | 一个木糖单体和一个葡萄糖单体 | β(1→6) |
多糖
[edit | edit source]多糖是由重复单元(单糖或二糖)通过糖苷键连接而成的聚合碳水化合物结构。 这些结构通常是线性的,但可能包含不同程度的支化。 多糖通常是相当异质的,包含重复单元的细微修饰。 这些大分子取决于结构,可能具有与其单糖构建块不同的特性。 它们可能是无定形的,甚至不溶于水。 多糖的一般式为 Cx(H2O)y,其中 x 通常是 200 到 2500 之间的很大数字。 考虑到聚合物主链中的重复单元通常是六碳单糖,一般式也可以表示为 (C6H10O5)n,其中 40≤n≤3000。
储存多糖
[edit | edit source]淀粉或淀粉是一种碳水化合物,由许多通过糖苷键连接在一起的葡萄糖单元组成。 这种多糖由所有绿色植物作为能量储存产生。 它是人类饮食中最重要的碳水化合物,包含在诸如马铃薯、小麦、玉米(玉米)、稻米和木薯等主食中。 纯淀粉是一种白色、无味、无味的粉末,不溶于冷水或酒精。 它由两种类型的分子组成:直链和螺旋状的直链淀粉和支链的支链淀粉。 淀粉通常含有 20% 到 25% 的直链淀粉和 75% 到 80% 的支链淀粉,具体取决于植物。 糖原是动物的葡萄糖储存,是支链淀粉的更支化形式。 淀粉被加工以生产加工食品中的许多糖。 当溶解在温水中时,它可用作增稠剂、硬化剂或粘合剂,形成小麦糊。 直链淀粉由 α(1→4) 结合的葡萄糖分子组成。 葡萄糖上的碳原子编号,从醛(C=O)碳开始,因此,在直链淀粉中,一个葡萄糖分子上的 1-碳与下一个葡萄糖分子上的 4-碳连接(α(1→4) 键)。 直链淀粉的结构式如右图所示。 重复葡萄糖亚基(n)的数量通常在 300 到 3000 的范围内,但可以达到数千。 直链淀粉链可以采取三种主要形式。 它可以以无序的无定形构象或两种不同的螺旋形存在。 它可以以双螺旋(A 或 B 型)与自身结合,或者可以与另一个疏水性客体分子(如碘、脂肪酸或芳香族化合物)结合。 这被称为 V 型,也是支链淀粉与直链淀粉结合形成淀粉的方式。 在这一组中,有许多不同的变体。 每个都用 V 表示,然后用下标表示每个周期的葡萄糖单元数。 最常见的是 V6 型,每个周期有六个葡萄糖单元。 V8 以及可能存在的 V7 型也存在。 这些为客体分子提供了一个更大的空间进行结合。 这种线性结构可以在 φ 和 ψ 角周围进行一些旋转,但总的来说,结合的葡萄糖环氧原子位于结构的一侧。 α(1→4) 结构促进了螺旋结构的形成,使得一个葡萄糖分子上 2-碳结合的氧原子与下一个葡萄糖分子上 3-碳之间形成氢键成为可能。 支链淀粉是一种可溶性多糖,是植物中发现的葡萄糖高度支化聚合物。 它是淀粉的两种成分之一,另一种是直链淀粉。 葡萄糖单元以线性方式通过 α(1→4) 糖苷键连接。 支化发生在每 24 到 30 个葡萄糖单元出现一次的 α(1→6) 键处。 相比之下,直链淀粉包含很少的 α(1→6) 键,这导致它水解速度更慢,但密度更高。 它在动物中的对应物是糖原,它具有相同的组成和结构,但支化程度更高,每 8 到 12 个葡萄糖单元出现一次。 植物将淀粉储存在称为淀粉体的特殊细胞器中。 当细胞工作需要能量时,植物会水解淀粉,释放葡萄糖亚基。 食用植物性食物的人类和其他动物也使用淀粉酶,这种酶可以帮助分解支链淀粉。 淀粉的重量大约为 70% 的支链淀粉,尽管它会因来源而异(例如,中等粒度的米饭更高,达到 100%,蜡质米饭、蜡质马铃薯淀粉和蜡质玉米,而长粒米、淀粉玉米和红皮马铃薯则更低)。 支链淀粉高度支化,由 2,000 到 200,000 个葡萄糖单元组成。 它的内链由 20-24 个葡萄糖亚基组成。[41]
糖原是作为动物和真菌细胞中第二长期的能量储存的分子。 它主要由肝脏和肌肉制造,但也可能通过糖原生成在脑和胃中制造。 糖原是淀粉的类似物,是植物中的一种分支较少的葡萄糖聚合物,通常被称为动物淀粉,与支链淀粉具有相似的结构。 糖原以许多细胞类型中细胞质中的颗粒形式存在,在葡萄糖循环中起着重要作用。 糖原形成了一个能量储备,可以快速动员以满足对葡萄糖的突然需求,但它不如甘油三酯(脂类)的能量储备紧凑。 在肝脏肝细胞中,糖原可以构成饭后新鲜重量的 8%(成人 100-120 克)。 只有储存在肝脏中的糖原才能被其他器官利用。 在肌肉中,糖原的浓度很低(占肌肉质量的 1% 到 2%)。 但是,体内储存的糖原量——尤其是在红细胞、肝脏和肌肉中——主要取决于体育锻炼、基础代谢率和饮食习惯,例如间歇性禁食。 少量糖原存在于肾脏中,脑和白细胞中某些神经胶质细胞中存在更少量的糖原。 子宫在怀孕期间也会储存糖原以滋养胚胎。

结构多糖
[edit | edit source]
纤维素 植物的结构成分主要由纤维素构成。木材主要由纤维素和木质素组成,而纸张和棉花几乎完全由纤维素构成。纤维素是一种由重复的葡萄糖单元通过β-键连接而成的聚合物。人类和其他许多动物缺乏分解β-键的酶,因此无法消化纤维素。某些动物可以消化纤维素,因为它们的肠道中存在含有这种酶的细菌。典型的例子是白蚁。纤维素无味,无臭,亲水性,接触角为20-30度,不溶于水和大多数有机溶剂,具有手性,可生物降解。它可以通过在高温下用浓酸处理,化学分解成葡萄糖单元。纤维素源于D-葡萄糖单元,通过β(1→4)-糖苷键缩合。这种连接模式与淀粉、糖原和其他碳水化合物中存在的α(1→4)-糖苷键的连接模式形成对比。纤维素是直链聚合物:与淀粉不同,没有卷曲或分支发生,并且该分子采用延伸的、相当僵硬的棒状构象,这得益于葡萄糖残基的赤道构象。来自一条链的葡萄糖上的多个羟基与同一链或相邻链上的氧分子形成氢键,将这些链牢固地保持在一起,并形成具有高抗拉强度的微纤维。这种强度在细胞壁中很重要,在细胞壁中,微纤维被网状编织到碳水化合物基质中,赋予植物细胞刚性。与淀粉相比,纤维素也更具结晶性。淀粉在水中加热到60-70℃以上时(如烹饪时)会经历结晶态到无定形态的转变,而纤维素需要在320℃的温度和25 MPa的压力下才能在水中变为无定形。已知纤维素具有几种不同的结晶结构,对应于链之间和链内部氢键的位置。天然纤维素是纤维素I,具有Iα和Iβ结构。细菌和藻类产生的纤维素富含Iα,而高等植物的纤维素主要由Iβ组成。再生纤维素纤维中的纤维素是纤维素II。纤维素I到纤维素II的转化是不可逆的,表明纤维素I是亚稳态的,而纤维素II是稳定的。通过各种化学处理,可以产生纤维素III和纤维素IV结构。纤维素的许多性质取决于其链长或聚合度,即构成一个聚合物分子的葡萄糖单元数量。来自木浆的纤维素的典型链长在300到1700个单元之间;棉花和其他植物纤维以及细菌纤维素的链长在800到10,000个单元之间。[10] 由纤维素分解产生的具有非常小链长的分子被称为纤维糊精;与长链纤维素相比,纤维糊精通常溶于水和有机溶剂。植物来源的纤维素通常与半纤维素、木质素、果胶和其他物质混合在一起,而微生物纤维素非常纯净,具有更高的含水量,并且由长链组成。纤维素可溶于铜乙二胺(CED)、镉乙二胺(Cadoxen)、N-甲基吗啉N-氧化物和氯化锂/二甲基甲酰胺。这被用于从溶解浆生产再生纤维素(如粘胶和赛璐玢)。[42]
几丁质 几丁质是许多天然存在的聚合物中的一种。它是世界上最丰富的天然材料之一。随着时间的推移,它在自然环境中可以生物降解。它的分解可以由称为几丁质酶的酶催化,这些酶由细菌和真菌等微生物分泌,并由一些植物产生。其中一些微生物对来自几丁质分解的简单糖具有受体。如果检测到几丁质,它们就会产生酶来消化它,通过裂解糖苷键将其转化为简单糖和氨。从化学角度来看,几丁质与壳聚糖(几丁质的更易溶于水的衍生物)密切相关。它也与纤维素密切相关,因为它是葡萄糖衍生物的长而未分支的链。这两种材料都有助于结构和强度,保护生物体。几丁质是一种含氮的修饰多糖;它由N-乙酰氨基葡萄糖单元(准确地说是2-(乙酰氨基)-2-脱氧-D-葡萄糖)合成。这些单元形成共价β-1,4键(类似于形成纤维素的葡萄糖单元之间的键)。因此,几丁质可以被描述为每个单体上的一个羟基被乙酰胺基取代的纤维素。这使得相邻聚合物之间可以进行更多的氢键结合,从而使几丁质聚合物基质的强度增加。在未修饰的形式下,几丁质是半透明的、柔韧的、有弹性的,而且非常坚韧。然而,在节肢动物中,它经常被修饰,嵌入硬化的蛋白质基质中,形成外骨骼的大部分。在纯净的形式下,它是皮革状的,但是当与碳酸钙一起结晶时,它会变得更硬。通过比较毛毛虫(未修饰)的身体壁和甲虫(修饰)的身体壁,可以看到未修饰和修饰形式之间的差异。N-乙酰氨基葡萄糖(N-乙酰-D-葡萄糖胺,或GlcNAc,或NAG)是葡萄糖的单糖衍生物。它是葡萄糖胺和乙酸之间的酰胺。它的分子式为C8H15NO6,摩尔质量为221.21 g/mol,在几个生物系统中很重要。[43]
它是细菌细胞壁中生物聚合物的一部分,由GlcNAc和N-乙酰胞壁酸(MurNAc)的交替单元构成,在MurNAc的乳酸残基处与寡肽交联。这种分层结构被称为肽聚糖。GlcNAc是聚合物几丁质的单体单元,几丁质构成昆虫和甲壳类动物的外壳。与葡萄糖醛酸聚合形成透明质酸。
阿拉伯木聚糖 阿拉伯木聚糖是两种戊糖 - 阿拉伯糖和木糖的共聚物。

细菌多糖代表了各种各样的生物大分子,包括肽聚糖、脂多糖、荚膜和胞外多糖;这些化合物的功能范围从结构性细胞壁成分(例如肽聚糖)和重要的毒力因子(例如金黄色葡萄球菌中的聚-N-乙酰氨基葡萄糖)到使细菌能够在恶劣环境中生存(例如绿脓杆菌在人肺中)。多糖生物合成是一个严格调控的、能量密集的过程,了解调节和能量守恒、聚合物修饰和合成以及外部生态功能之间的微妙相互作用是一个巨大的研究领域。潜在的好处是巨大的,例如应该能够开发新的抗菌策略(例如新的抗生素和疫苗)以及商业开发以开发新的应用。
细菌荚膜多糖 致病菌通常会产生一层厚厚的、粘液状的多糖层。这种“荚膜”会覆盖细菌表面上的抗原蛋白,否则这些抗原蛋白会引起免疫反应,从而导致细菌被破坏。荚膜多糖是水溶性的,通常是酸性的,并且其分子量在100-1000 kDa的范围内。它们是线性的,并且由一个到六个单糖的规则重复亚基组成。结构多样性巨大;仅大肠杆菌就产生了近两百种不同的多糖。荚膜多糖的混合物,无论是结合的还是天然的,都用作疫苗。细菌以及许多其他微生物,包括真菌和藻类,通常会分泌多糖作为一种进化适应,帮助它们粘附在表面并防止它们干燥。人类已经将其中一些多糖开发成了有用的产品,包括黄原胶、葡聚糖、魏兰胶、结冷胶、迪坦胶和支链淀粉。大多数这些多糖在非常低的浓度下溶解在水中时,会表现出有趣且非常有用的粘弹性。这使得许多食品和各种液体消费品,例如乳液、清洁剂和油漆等,在静止时呈现出粘稠的外观,但在施加最轻微的剪切力时(例如擦拭、倾倒或刷涂时)呈现出流动性。这种性质被称为假塑性或剪切稀化。[44]
肽聚糖 肽聚糖,也称为胞壁质,是一种由糖和氨基酸组成的聚合物,形成细菌(但不包括古细菌)质膜外侧的网状层,构成细胞壁。糖成分由交替的β-(1,4) 连接的N-乙酰氨基葡萄糖和N-乙酰胞壁酸残基组成。连接到N-乙酰胞壁酸的是一个由三到五个氨基酸组成的肽链。肽链可以与另一条链的肽链交联,形成三维网状层。细菌细胞壁中的肽聚糖层是由两条交替的氨基糖线性链形成的晶格结构,即N-乙酰氨基葡萄糖(GlcNAc或NAG)和N-乙酰胞壁酸(MurNAc或NAM)。交替的糖通过β-(1,4)-糖苷键连接。每个MurNAc都连接到一个短的(4-到5-残基)氨基酸链,在大肠杆菌(一种革兰氏阴性菌)中包含D-丙氨酸、D-谷氨酸和间二氨基庚二酸,或在金黄色葡萄球菌(一种革兰氏阳性菌)中包含L-丙氨酸、D-谷氨酰胺、L-赖氨酸和D-丙氨酸。这些氨基酸,除了L-氨基酸外,在蛋白质中不存在,被认为有助于抵御大多数肽酶的攻击。不同线性氨基糖链中氨基酸之间的交联在转肽酶的帮助下发生,并导致形成坚固而刚性的三维结构。特定的氨基酸序列和分子结构因细菌种类而异。[45]
LPS
脂多糖 (LPS) 是革兰氏阴性菌外膜的主要成分,对细菌的结构完整性贡献巨大,并保护膜免受某些化学攻击。LPS 还增加了细胞膜的负电荷,并有助于稳定整个膜结构。它对革兰氏阴性菌至关重要,如果它发生突变或被移除,这些细菌将会死亡。LPS 是一种内毒素,会引发正常动物免疫系统的强烈反应。它也与细菌生态学中的非致病性方面有关,包括表面粘附、噬菌体敏感性和与捕食者(如变形虫)的相互作用。LPS 作为典型的内毒素,因为它与 CD14/TLR4/MD2 受体复合物结合,从而促进许多细胞类型(尤其是巨噬细胞)中促炎细胞因子的分泌。在免疫学中,“LPS 挑战”一词指的是将受试者暴露于可能充当毒素的 LPS 的过程。LPS 也是一种外源性致热原(外部发热物质)。由于对革兰氏阴性菌至关重要,因此这些分子成为了新型抗菌剂的候选靶点。[46]
一些研究人员对归因于所有脂多糖的普遍毒性作用的报告表示怀疑,特别是对于蓝细菌。它包含三个部分
O 抗原(或 O 多糖)
核心寡糖
脂质 A

术语糖类是指多糖或寡糖。糖类通常仅由单糖的 O-糖苷键组成。例如,纤维素是一种糖类(或更具体地说,是一种葡聚糖),由β-1,4-连接的 D-葡萄糖组成,而几丁质是一种糖类,由β-1,4-连接的 N-乙酰-D-葡萄糖胺组成。糖类可以是单糖残基的同聚物或异聚物,可以是线性的或分支的。糖类也可以用来指糖缀合物的碳水化合物部分,例如糖蛋白、糖脂或蛋白聚糖。糖类可以发现附着在蛋白质上,如糖蛋白和蛋白聚糖。一般来说,它们存在于细胞的外表面。O-连接和 N-连接糖类在真核生物中非常常见,但也可能存在于原核生物中,尽管并不常见。[48]
N-连接糖类
N-连接糖类发现附着在序列中的天冬酰胺的 R-基团氮 (N) 上。序列是一个 Asn-X-Ser 或 Asn-X-Thr 序列,其中 X 是除脯氨酸以外的任何氨基酸,并且可能由 N-乙酰半乳糖胺、半乳糖、神经氨酸、N-乙酰葡糖胺、果糖、甘露糖、岩藻糖和其他单糖组成。
组装:在真核生物中,N-连接糖类源自一个核心 14 糖单元,该单元在细胞质和内质网中组装。首先,两个 N-乙酰葡糖胺残基附着在内质网膜外侧的脂质多萜醇磷酸上。然后向该结构添加五个甘露糖残基。此时,部分完成的核心糖类翻转到内质网膜的另一侧,因此现在位于内质网腔内。然后组装在内质网内继续进行,添加了另外四个甘露糖残基。最后,三个葡萄糖残基被添加到该结构中。完全组装后,糖类由糖基转移酶寡糖基转移酶整体转移到内质网腔内的新生肽链上。因此,N-连接糖类的这种核心结构由 14 个残基组成(3 个葡萄糖、9 个甘露糖和 2 个 N-乙酰葡糖胺)。[49]
一旦转移到新生肽链,N-连接糖类通常会经历广泛的加工反应,其中三个葡萄糖残基被去除,以及一些甘露糖残基,具体取决于所讨论的 N-连接糖类。葡萄糖残基的去除取决于蛋白质的正确折叠。这些加工反应发生在高尔基体中。修饰反应可能包括在糖上添加磷酸基团或乙酰基团,或者添加新的糖,如神经氨酸。高尔基体内 N-连接糖类的加工和修饰不遵循线性途径。因此,许多不同的 N-连接糖类结构变异是可能的,具体取决于高尔基体的酶活性。
功能和重要性 N-连接糖类在真核细胞中蛋白质的正确折叠中极其重要。内质网中的伴侣蛋白,如钙联蛋白和钙网蛋白,与核心 N-连接糖类上存在的三个葡萄糖残基结合。然后这些伴侣蛋白有助于糖类附着的蛋白质折叠。正确折叠后,三个葡萄糖残基被去除,糖类继续进行进一步的加工反应。如果蛋白质未能正确折叠,则会重新附着三个葡萄糖残基,从而使蛋白质重新与伴侣蛋白结合。这个循环可能会重复几次,直到蛋白质达到其正确的构象。如果蛋白质反复未能正确折叠,它将从内质网中排出并被细胞质蛋白酶降解。N-连接糖类还通过空间效应有助于蛋白质折叠。例如,肽中的半胱氨酸残基可能由于附近糖类的大小而暂时被阻止与其他半胱氨酸残基形成二硫键。因此,N-连接糖类的存在使细胞能够控制哪些半胱氨酸残基将形成二硫键。N-连接糖类还在细胞间相互作用中发挥重要作用。例如,肿瘤细胞会产生异常的 N-连接糖类。这些被自然杀伤细胞上的 CD337 受体识别为问题细胞是癌细胞的标志。降解性溶酶体酶的靶向也通过 N-连接糖类实现。N-连接糖类用 6-磷酸甘露糖残基修饰,作为将该糖类附着的蛋白质转移到溶酶体的信号。这两种蛋白质:CI-MPR(阳离子独立 6-磷酸甘露糖受体)和 CD-MPR(阳离子依赖 6-磷酸甘露糖受体)实现了通过 6-磷酸甘露糖的存在对溶酶体酶的识别和转运。[50]
O-连接糖类
在真核生物中,O-连接糖类在高尔基体中以每次一个糖的方式组装在肽链的丝氨酸或苏氨酸残基上。与 N-连接糖类不同,目前还没有已知的共有序列。然而,在丝氨酸或苏氨酸相对于 -1 或 +3 的位置放置脯氨酸残基有利于 O-连接糖基化。
组装 O-连接糖类合成中附着的第一个单糖是 N-乙酰半乳糖胺。在此之后,几种不同的途径是可能的。通过添加半乳糖生成核心 1 结构。通过向核心 1 结构的 N-乙酰半乳糖胺添加 N-乙酰葡糖胺生成核心 2 结构。通过向原始 N-乙酰半乳糖胺添加单个 N-乙酰葡糖胺生成核心 3 结构。通过向核心 3 结构添加第二个 N-乙酰葡糖胺生成核心 4 结构。其他核心结构是可能的,尽管不常见。
O-连接糖类中常见的结构主题是将聚乳糖胺单元添加到各种核心结构中。这些是通过重复添加半乳糖和 N-乙酰葡糖胺单元形成的。O-连接糖类上的聚乳糖胺链通常通过添加唾液酸残基(类似于神经氨酸)来封端。如果岩藻糖残基也被添加到倒数第二个残基,则会形成唾液酸 Lewis x (SLex)) 结构。[51]
蛋白聚糖是高度糖基化的糖蛋白。基本的蛋白聚糖单元由一个“核心蛋白”组成,该蛋白具有一个或多个共价连接的糖胺聚糖 (GAG) 链。连接点是丝氨酸残基,糖胺聚糖通过四糖桥连接到该残基(例如:硫酸软骨素-GlcA-Gal-Gal-Xyl-PROTEIN)。丝氨酸残基通常位于 -Ser-Gly-X-Gly- 序列中(其中 X 可以是任何氨基酸残基),尽管并非所有具有该序列的蛋白质都具有连接的糖胺聚糖。这些链是长而线性的碳水化合物聚合物,由于硫酸和糖醛酸基团的存在,在生理条件下带负电荷。蛋白聚糖存在于结缔组织中。蛋白聚糖可以根据其糖胺聚糖链的性质进行分类。蛋白聚糖也可以按大小(kDa)进行分类。[52]
类型包括
| 糖胺聚糖 | 小蛋白聚糖 | 大蛋白聚糖 |
|---|---|---|
| 硫酸软骨素/硫酸皮肤素 | 装饰蛋白,kDa=36 大蛋白聚糖,kDa=38 |
维多糖,kDa=260-370,存在于许多成人组织中,包括血管和皮肤 |
| 硫酸乙酰肝素/硫酸软骨素 | 睾丸蛋白聚糖,kDa=44 | 珠蛋白聚糖,kDa=400-470 |
| 硫酸软骨素 | 神经腱蛋白,kDa=136 聚集蛋白聚糖,kDa=220,是软骨中主要的蛋白聚糖。 | |
| 硫酸角质素 | 纤维调节蛋白,kDa=42 亮氨酸蛋白聚糖,kDa=38 |
某些成员被认为是“小型富含亮氨酸蛋白聚糖家族”(SLRP)的成员。这些包括装饰蛋白、大蛋白聚糖、纤维调节蛋白和亮氨酸蛋白聚糖。
- ↑ http://en.wikipedia.org/w/index.php?title=Carbohydrate&oldid=424717553
- ↑ http://en.wikipedia.org/w/index.php?title=Carbohydrate&oldid=424717553
- ↑ http://en.wikipedia.org/w/index.php?title=Anomeric_effect&oldid=409805462
- ↑ http://en.wikipedia.org/w/index.php?title=Carbohydrate&oldid=424717553
- ↑ http://en.wikipedia.org/w/index.php?title=Carbohydrate&oldid=424717553
- ↑ http://en.wikipedia.org/w/index.php?title=Carbohydrate_conformation&oldid=421342369
- ↑ http://en.wikipedia.org/w/index.php?title=Carbohydrate_conformation&oldid=421342369
- ↑ http://en.wikipedia.org/w/index.php?title=Pyranose&oldid=392158898
- ↑ http://en.wikipedia.org/w/index.php?title=Pyranose&oldid=392158898
- ↑ Ionescu, A.R.; Berces, A.; Zgierski, M.Z.; Whitfield, D.M.; Nukada, T. (2005). "Conformational Pathways of Saturated Six-Membered Rings. A Static and Dynamical Density Functional Study". The Journal of Physical Chemistry A. 109 (36): 8096–8105. doi:10.1021/jp052197t. PMID 16834195.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Biarns, X.; Ardvol, A.; Planas, A.; Rovira, C.; Laio, A.; Parrinello, M. (2007). "The Conformational Free Energy Landscape of b-D-Glucopyranose. Implications for Substrate Preactivation in b-Glucoside Hydrolases". Journal of the American Chemical Society. 129 (35): 10686–10693. doi:10.1021/ja068411o. PMID 17696342.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ http://en.wikipedia.org/w/index.php?title=Pyranose&oldid=392158898
- ↑ http://en.wikipedia.org/w/index.php?title=Carbohydrate&oldid=424717553
- ↑ http://en.wikipedia.org/w/index.php?title=Carbohydrate&oldid=424717553
- ↑ http://en.wikipedia.org/w/index.php?title=Tetrose&oldid=401443888
- ↑ http://en.wikipedia.org/wiki/Pentose
- ↑ http://en.wikipedia.org/w/index.php?title=Hexose&oldid=403295413
- ↑ http://en.wikipedia.org/w/index.php?title=Hexose&oldid=403295413
- ↑ a b Morrison, Robert Thornton and Boyd, Robert Neilson. Organic Chemistry (2nd ed.). Allyn and Bacon.
{{cite book}}: CS1 maint: multiple names: authors list (link) Library of Congress catalog 66-25695 - ↑ http://en.wikipedia.org/w/index.php?title=Hexose&oldid=403295413
- ↑ http://en.wikipedia.org/w/index.php?title=Hexose&oldid=403295413
- ↑ http://en.wikipedia.org/w/index.php?title=Hexose&oldid=403295413
- ↑ http://en.wikipedia.org/w/index.php?title=Heptose&oldid=418087311
- ↑ http://en.wikipedia.org/w/index.php?title=Heptose&oldid=418087311
- ↑ http://en.wikipedia.org/w/index.php?title=Monosaccharide&oldid=423519127
- ↑ IUPAC 金书 变旋现象
- ↑ Derek Horton (2008). "The Development of Carbohydrate Chemistry and Biology". Carbohydrate Chemistry, Biology and Medical Applications: 1–28. doi:10.1016/B978-0-08-054816-6.00001-X.
- ↑ Augustin-Pierre Dubrunfaut—An early sugar chemist. Hewitt G. Fletcher, J. Chem. Educ., 1940, 17 (4), p 153, DOI: 10.1021/ed017p153
- ↑ Francis Carey (2000). Organic Chemistry (4th, McGraw-Hill Higher Education Press ed.).
- ↑ http://en.wikipedia.org/w/index.php?title=Monosaccharide&oldid=423519127
- ↑ http://en.wikipedia.org/w/index.php?title=Disaccharide&oldid=424536634
- ↑ http://en.wikipedia.org/w/index.php?title=Disaccharide&oldid=424536634
- ↑ http://en.wikipedia.org/w/index.php?title=Disaccharide&oldid=424536634
- ↑ http://en.wikipedia.org/w/index.php?title=Disaccharide&oldid=424536634
- ↑ http://en.wikipedia.org/w/index.php?title=Maltose&oldid=421158773
- ↑ http://en.wikipedia.org/w/index.php?title=Trehalose&oldid=422266481
- ↑ http://en.wikipedia.org/w/index.php?title=Cellobiose&oldid=420992539
- ↑ F.W. Parrish (1968 年 7 月). "曲霉菌孢子对麦芽糖的隐蔽性和麦芽糖醇对转运的诱导作用,一种常见的麦芽糖污染物" (PDF). J. Bacteriol. 美国微生物学会. 96 (1): 227–233. PMC 252277. PMID 5690932. 检索于 2008 年 11 月 21 日。
{{cite journal}}: 未知参数|coauthors=被忽略 (|author=建议) (帮助) - ↑ Matsuda, K.; Abe, Y; Fujioka, K (1957). "Kojibiose (2-O-α-D-Glucopyranosyl-D-Glucose): Isolation and Structure: Chemical Synthesis". Nature. 180 (4593): 985. doi:10.1038/180985a0. PMID 13483573.
{{cite journal}}: 未知参数|month=被忽略 (帮助) - ↑ T. Taga (1997). "α,β-海藻糖一水合物". Acta Cryst. C53: 234–236. doi:10.1107/S0108270196012693.
{{cite journal}}: 未知参数|coauthors=被忽略 (|author=建议) (帮助) - ↑ http://en.wikipedia.org/wiki/Starch
- ↑ http://en.wikipedia.org/wiki/Cellulose
- ↑ http://en.wikipedia.org/wiki/Chitin
- ↑ http://en.wikipedia.org/w/index.php?title=Polysaccharide&oldid=422863369
- ↑ http://en.wikipedia.org/w/index.php?title=Peptidoglycan&oldid=422040621
- ↑ http://en.wikipedia.org/w/index.php?title=Lipopolysaccharide&oldid=423382830
- ↑ Ruddock & Molinari (2006) 细胞科学杂志 119, 4373-4380
- ↑ http://en.wikipedia.org/w/index.php?title=Glycan&oldid=417977294
- ↑ http://en.wikipedia.org/w/index.php?title=Glycan&oldid=417977294
- ↑ http://en.wikipedia.org/w/index.php?title=Glycan&oldid=417977294
- ↑ http://en.wikipedia.org/wiki/Glycan
- ↑ http://en.wikipedia.org/w/index.php?title=Proteoglycan&oldid=423972661