蛋白质组学/蛋白质样品制备/质谱分析样品制备
质谱 (MS) 被证明是蛋白质组学中更灵敏的技术之一,虽然使其成为一项非常有用的技术,但也使其容易受到严格的样品制备要求的影响。任何特定质谱实验的条件最终将决定必要的制备程度和类型,但一些概念可以应用于任何质谱实验,例如富集和分级分离。此外,由于目前越来越重视涉及质谱的高通量技术,因此对用于蛋白质和肽提取的上游质谱自动化和简化的样品制备工具的需求也日益增长。
任何蛋白质组学实验,尤其是质谱实验的第一步,通常是降低样品的复杂性;或对样品进行分级分离。分级分离的目标通常是去除“蛋白质组中高丰度的组分”[1],然后是“随后对中等至低丰度的蛋白质进行分级分离”[1],以产生浓缩的蛋白质样品,这些蛋白质有可能具有临床相关性。有许多可用的分级分离方案和工具,并且使用不止一种方法来充分减少样品的复杂性并不少见。可以根据大小、电荷、疏水性和/或结合亲和力对蛋白质样品进行分级分离。这些特性通常是许多可用试剂盒的基础,这些试剂盒能够通过从样品(如血清)中分离出高丰度蛋白质来富集样品。此类试剂盒的例子包括贝克曼库尔特公司的ProteomeLab IgY-12离心和液相色谱柱试剂盒,该试剂盒“选择性地分离血清或血浆中发现的12种高丰度蛋白质”[1],或Bio-Rad公司的ReadyPrep蛋白质提取试剂盒,该试剂盒“根据细胞位置(细胞质/细胞核部分、膜蛋白以及专门参与细胞内信号传导的膜蛋白)对蛋白质混合物进行分级分离”。[1]
与大多数其他蛋白质组学实验相比,在将蛋白质样品引入质谱仪之前,样品的净化更为重要,这主要是由于该技术的灵敏度,但也因为“脏样品”可能对仪器造成相当大的损害。
在质谱灵敏度方面,“需要去除蛋白质组学样品制备中常用的去污剂、[离子抑制]盐和变性剂以提高溶解度”[1],因为它们会影响分析。在为质谱净化样品时,可以使用本章污染物去除部分中描述的任何数量的概念。最后,应该注意的是,在试图最大化数据质量的同时,保持对蛋白质产量的认识非常重要。[1]
在此处插入与蛋白质和肽的18O标记相关的信息。
- ↑ a b c d e f Glaser, V. (2006) 质谱上游样品制备:进展侧重于样品净化、分级分离和分离。基因工程与生物技术新闻(第 26 卷,第 10 期)。获取自 http://www.genengnews.com/articles/chitem.aspx?aid=1667&chid=1
2. 病原体全面蛋白质表征的蛋白质组学样品制备程序优化 Heather M. Mottaz-Brewer、Angela D. Norbeck、Joshua N. Adkins、Nathan P. Manes、Charles Ansong、Liang Shi、Yasuko Rikihisa、Takane Kikuchi、Scott W. Wong、Ryan D. Estep、Fred Heffron、Ljiljana Pasa-Tolic 和 Richard D. Smith=系统(http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=2628077&tool=pmcentrez)
3. http://www.flickr.com/photos/92329000@N00/387807596/
- Jörg von Hagen,VCH-Wiley 2008 蛋白质组学样品制备。 ISBN 978-3-527-31796-7
Heather M. Mottaz-Brewer、Angela D. Norbeck、Joshua N. Adkins、Nathan P. Manes、Charles Ansong、Liang Shi、Yasuko Rikihisa、Takane Kikuchi、Scott W. Wong、Ryan D. Estep、Fred Heffron、Ljiljana Pasa-Tolic 和 Richard D. Smith J Biomol Tech. 2008 年 12 月;19(5):285–295。PMCID:PMC2628077
主要关注点
实验可以得出的结果取决于所用样品的制备方式。优化样品制备步骤以获得更好的质谱结果,有助于更好地理解宿主病原体相互作用。
摘要

质谱可用于蛋白质组学,以了解病原体与宿主的相互作用。但是,在任何分析中,结果在很大程度上取决于所用样品的特性。改变实验中样品的制备方式可以带来更好的结果。样品处理中有很多不同的步骤可以进行优化以获得更好的结果。但是,需要绘制影响图以确定对样品制备程序所做的更改。例如,选择性的提高会导致灵敏度的降低,反之亦然。还必须考虑生物量损失。可以优化的不同步骤包括
- 目标蛋白 - 应识别目标蛋白并找出其可能的位置。实验设计应牢记这一点。
- 生长条件 - 可以设计最适合特定宿主病原体的生长条件
- 样品制备 - 可以更改所用样品的大小及其制备方式,以便针对每个实验进行优化
- 样品分析平台 - 应考虑用于分析样品的平台
- 数据分析 – 发现的数据如何进行分析非常重要。由于并非所有细菌研究都经过了最佳测序,因此最佳的数据分析发挥着重要作用。
调整上述的不同步骤可以带来更好的结果,从而找出病原体和宿主之间的相互作用,最终导致药物的发现。
新术语
- HeLa细胞
- 用于研究的永生细胞系,来源于海拉·拉克斯的宫颈癌细胞(http://en.wikipedia.org/wiki/HeLa)
- BCA蛋白测定法
- 双缩脲酸测定法是一种用于测定溶液中蛋白质总量或蛋白质浓度的测定方法。颜色从绿色变为紫色的程度表明蛋白质的含量。
- SPE(固相萃取)
- 这是一种分离过程,用于根据其物理和化学性质从杂质混合物中去除某些化合物(http://en.wikipedia.org/wiki/Solid_Phase_Extraction)
- 影响图
- 它是决策情境的紧凑图形和数学表示。它是贝叶斯网络的推广,不仅可以对概率推理问题进行建模和求解,还可以对决策问题(遵循最大期望效用准则)进行建模和求解。(http://en.wikipedia.org/wiki/Influence_diagram)
- 脂质组学
- 细胞脂质的通路和网络研究。
课程相关性
- 本文讨论了样品制备和样品分析在实验分析中的重要性。它告诉我们可以在各个步骤中进行不同的优化以获得更好的结果。
赛默飞世尔科技(http://www.piercenet.com/products/browse.cfm?fldID=69893E05-475D-4DA1-9DE5-D37CCFA31DF7&Format=Print)
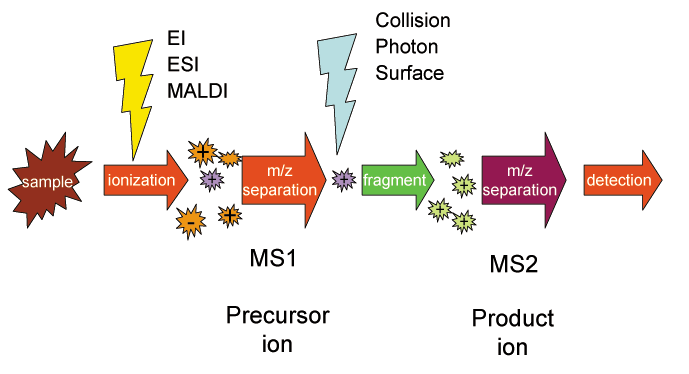
串联质谱示意图
主要关注点
可用于优化质谱结果的不同样品制备试剂盒和试剂
摘要
该网站介绍了可用于优化样品制备的不同试剂和试剂盒。可用的不同试剂盒包括:
- SILAC试剂盒和试剂 - 用于在细胞培养中使用氨基酸进行稳定同位素标记的试剂盒。它可以定量和识别蛋白质样品中相对差异变化。
- 串联质谱标签技术 - 等压化学标签,能够同时识别和定量不同样品中的蛋白质。
- 氘代交联剂的使用
- 用于优化样品制备的二维样品制备试剂盒和白蛋白去除试剂盒
- SilverSNAP染色剂,用于二维凝胶的银染,以提高灵敏度
- 强离子交换离心柱,用于轻松、更好的纯化
- 三氟乙酸,用于反相肽分离
- 甲酸安瓿瓶,作为无污染的替代品,用于制备用于蛋白质和肽的HPLC分离的洗脱溶剂
- PepClean C18离心柱,用于在不到30分钟内纯化或浓缩多个肽样品
- 蛋白质沉淀板,用于目标分子分离
- 磷酸肽分离试剂盒,用于从复杂的蛋白质消化物中分离磷酸化肽
- MALDI分析基质
新术语
- SILAC(细胞培养中氨基酸的稳定同位素标记)
- 一种基于质谱的技术,用于检测两个(或多个)样品之间蛋白质丰度的差异(http://en.wikipedia.org/wiki/SILAC)
- 氘代交联剂
- 化学试剂,在质谱研究中使用时,与非氘代类似物交联的蛋白质相比,会产生达尔顿位移。这两种类似物可用于蛋白质和肽的同位素标记。
- 洗脱
- 化学物质从色谱柱中出现。
- MALDI
- 基质辅助激光解吸电离(MALDI)是一种用于质谱的软电离技术,可以分析生物分子(如蛋白质、肽和糖等生物聚合物)和大型有机分子(如聚合物、树枝状聚合物和其他大分子),这些分子在用更传统的电离方法电离时往往很脆弱并会发生碎裂(http://en.wikipedia.org/wiki/MALDI-TOF)
课程相关性
该网站详细介绍了可以在蛋白质组学实验室中用来优化样品制备的不同工具和试剂盒。
- 基于MS的蛋白质组学中的18O稳定同位素标记
叶晓英、布莱恩·卢克、托克尔·安德森和约西普·布隆德尔。功能基因组学和蛋白质组学简报。第8卷。第2号。136-144。http://www.ncbi.nlm.nih.gov/pubmed/19151093
- 审稿人:亚瑟·普林西比
- 本文综述了一种使用18O同位素进行蛋白质组学研究的质谱(MS)标记技术。文章对该技术的历史和原理进行了详尽的背景介绍,然后解释了不同的具体技术应用。文章最后对最佳实践情况进行了评估。该技术应用的领域包括:全局蛋白质组学研究、靶向蛋白质组学研究和翻译后修饰。
- 18O标记
- 使用氧同位素18O作为标记,通过掺入蛋白质或肽中。
- (http://pubs.acs.org/doi/abs/10.1021/ac010043d)
- 酶介导的同位素掺入
- 使用酶作为催化剂来引发导致同位素掺入的化学反应。
- (http://en.wikipedia.org/wiki/Enzyme_kinetics)
- 稳定同位素标记
- 使用尚未观察到衰变的同位素作为标记。
- (http://en.wikipedia.org/wiki/Stable_isotope)
- 基于MS的蛋白质组学
- 通过向分析物中添加稳定同位素并观察质量位移来区分蛋白质的相对数量。
- (http://en.wikipedia.org/wiki/Quantitative_proteomics#Mass_spectrometry-based_proteomics)
- 无偏蛋白质组覆盖
- 分析在给定时间段内针对给定环境(如组织或细胞)表达的完整蛋白质集。
- (http://en.wikipedia.org/wiki/Proteome)
- 翻译后修饰
- 蛋白质翻译后发生的化学修饰。
- (http://en.wikipedia.org/wiki/Post-translational_modifications)
- 蛋白质生物标志物
- 在疾病状态下产生的蛋白质,可用于检测该疾病。
- (http://en.wikipedia.org/wiki/Proteomics#Biomarkers)

- 虽然18O标记不是最常用的同位素标记技术,但它具有一定的优势。结果生成速度非常快,运行测定的所需材料相对便宜,并且所需的样品量很少。第三点很重要,因为它允许有效地使用数量有限的样品,例如通过临床方法获得的样品。
- 全局蛋白质组学研究:使用18O标记样品在蛋白质组范围内进行定量分析。由于可变切割,可能会导致结果出现错误。然而,蛋白质组的无偏覆盖是优于基于二维凝胶电泳方法的主要优势。
- 靶向蛋白质组学研究:使用18O标记技术识别低丰度蛋白质。可用于早期检测疾病的生物标志物或识别细胞器分选和运输中使用的蛋白质。
- 翻译后修饰:使用18O标记来识别用于过程调控的蛋白质组。定量翻译前、翻译后和翻译后的蛋白质组丰度。
- 与其他技术相比:18O标记具有一定的优势,使其在适当条件下非常有用。试剂比其他测定技术相对便宜。测定周转时间短。这对于在临床环境中生成所需快速结果非常有用。可以使用少量样品进行测定。在处理供应有限的样品时,使用更少的样品非常重要。
- 结论,技术的选择取决于实验设计。虽然不总是最佳选择,但18O标记在快速且廉价地生成某些类型的信息方面非常有效。
- 本文概述了18O标记技术的多种应用。它对该技术和原理进行了非常全面的背景介绍。然后介绍了18O标记已应用和继续应用的主要领域。分解了该技术的历史,以及主要研究领域中的改进和突破。