结构生物化学/碳水化合物/碳水化合物和蛋白质
介绍
许多蛋白质要么在结构和目的上添加了碳水化合物,要么在细胞反应中使用碳水化合物作为底物。
碳水化合物结合分子和疟疾
在一篇名为Carbohydrate Binding Molecules in Malaria Pathology 的论文中,Alan Brown 和 Matthew K Higgins 研究了糖蛋白 和疟疾寄生虫之间的关系。
-
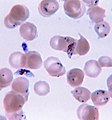
人类血液中的恶性疟原虫环状体和配子体。
-
疟疾的主要症状。
-
疟疾寄生虫在人体内的生命周期。
-
白纹伊蚊在人的手臂上吸血。
许多病原体,如细菌、病毒和寄生虫,利用碳水化合物结合分子与宿主相互作用。碳水化合物在蛋白质的修饰和功能中起着重要作用。对病原性碳水化合物结合分子的新见解提供了潜在的治疗靶点。糖蛋白在病原体与其宿主细胞的结合中起着关键作用。引起疟疾的寄生虫与人类的肝细胞 和红细胞相互作用。这种糖蛋白介导的结合对于宿主细胞入侵、移动、逃避免疫系统的检测和破坏至关重要。
疟疾寄生虫识别红细胞表面上的多种唾液酸化的蛋白质,以结合宿主细胞。疟疾寄生虫中的两个蛋白家族识别红细胞上的唾液酸:EBL(红细胞结合样) 和RBL(网织红细胞结合样)。这两个蛋白家族都包含与不同膜蛋白相互作用并导致不同途径的蛋白质;它们的功能可以是独立的,也可以是依赖唾液酸的,这使得病原体能够克服人类群体之间的多样性。这两个蛋白质都包含一个叫做RII的区域。该区域负责疟疾蛋白质结合宿主细胞的能力。EBL 和 RBL 对红细胞有多种结合和攻击方式。这意味着它可以通过多种不同的方式结合并避免被人类免疫系统破坏。
EBL 家族
EBL 家族由 RII 区域(由两个被称为 F1 和 F2 的杜菲结合样 (DBL) 结构域组成)、一个 C 末端富含半胱氨酸的区域和一个跨膜结构域组成。RII 区域是保守的;它在来自不同地理位置的菌株中显示出 98% 的序列同一性。研究人员对该家族成员之一 EBA-175 了解得更多。
EBA-175
EBA-175 结合红细胞的唾液酸化膜糖蛋白,即糖蛋白 A。其在入侵途径中的重要性已通过体外实验得到证实,在该实验中,针对 EBA-175 的抗体抑制了与糖蛋白 A 的结合并阻止了入侵。RII 区域EBA-175识别并结合糖蛋白 A,这是宿主细胞表面的一种糖蛋白。糖蛋白 A 表面具有特定的碳水化合物序列,这些序列对于结合的发生至关重要。当疟疾寄生虫结合到糖蛋白 A 时,它识别细胞表面上的唾液酸。这是一种很好的寄生虫攻击方法,因为唾液酸成分不太可能发生变化。然而,唾液酸的细微差异可能会阻止寄生虫的攻击。
然而,仅有唾液酸不足以进行病原体入侵。例如,糖蛋白 B 与糖蛋白 A 共享 11 个保守的唾液酸化 O 连接的聚糖,但不会结合 EBA-175。事实上,蛋白质链的特定方向对于最佳结合是必需的,其中 EBA-175 更可能直接与蛋白质相互作用。
在其晶体形式中,RII 区域的两个 DBL 结构域通过一个三个螺旋连接体连接,其中两个反平行单体形成二聚体。这种结构由两个带正电荷的通道组成。每个通道都由来自一个单体的 F1 结构域和来自另一个单体的 F2 结构域的残基排列而成。然而,在溶液中,EBA-175 似乎是浓度依赖性的,其中单体和二聚体的含量比随溶质浓度的变化而变化。因此,可以推测 EBA-175 以单体形式稳定,并且在高浓度下倾向于二聚化。
通过将 EBA-175 与 Neu5Ac(a2,3)Gal 共结晶,研究人员能够检测到糖分子,该糖分子位于二聚体通道附近,由两个单体的残基配位。这一观察结果有助于确定唾液酸结合位点,并导致了 EBA-175 通过与唾液酸和蛋白质链的相互作用,围绕糖蛋白 A 胞外域(膜表面的糖蛋白并延伸到细胞外空间)组装的模型。
还存在涉及 EBL 家族其他成员的替代入侵途径。特别是,EBA-140 缺少带电斑块和残基,这些斑块和残基被鉴定为在 EBA-175 中与唾液酸相互作用,而它仍然以唾液酸依赖的方式结合糖蛋白 C。因此,EBL 家族的每个成员似乎都有自己独特的唾液酸结合位点,不同于其他成员。
细胞粘附和逃避宿主检测
受感染的红细胞变得粘稠,并粘附到未受感染的红细胞上,形成被称为花环的团块。这可以防止检测到受感染的细胞并阻止脾脏介导的破坏,从而使感染继续在体内存活。在针对孕妇的疟疾中,红细胞会积累并导致胎盘炎症,可能导致胎儿死亡。结合 PfEMP1 蛋白并防止某些形式的疟疾粘附的抗体表明 PfEMP1 蛋白是潜在的治疗靶点。PfEMP1。这些 PfEMP1 蛋白由DBL(杜菲结合样)结构域组成。
PfEMP1 蛋白 PfEMP1 蛋白包含由多个 DBL 和 CIDR 结构域组成的超大型胞外域。不同的 PfEMP1 蛋白将与不同的受体相互作用。在 PfEMP1 蛋白中,VAR2CSA 是研究人员了解得最多的。PfEMP1s 迅速转换以避免被机体检测到。它们与各种蛋白质(CD36 和ICAM-1)以及碳水化合物相互作用。这些 PfEMPS1 之一就是VAR2CSA。
VAR2CSA
VAR2SCA 感染的红细胞对 4-硫酸化软骨素硫酸 A (CSA) 分子表现出特别强的亲和力。CSA 分子,尤其是那些与之密切相关的糖胺聚糖碳水化合物,几乎没有阻止与 VAR2CSA 相互作用的能力。此外,CSA 分子的蛋白质链不影响分子识别的特异性。在结构上,VAR2CSA 的六个 DBL 结构域中的四个单独结合 CSA。DBL3X 结构具有与 EBA-175 DBL 结构域相似的 α 螺旋结构,只是循环更长。
当存在硫酸根离子或二糖时,该结构域凹面表面的一个环将形成一个带正电荷的斑块和一个硫酸根结合口袋,这对于 CSA 结合至关重要。与 EBA-175 不同,VAR2CSA 具有更长、通常无序的循环,并且更通用。VAR2CSA 的通用性暗示 VAR2CSA 在入侵过程中比 EBA-175 具有更长的暴露于免疫系统的时间。DBL6e 结构域的结构类似于 DBL3X,但它没有硫酸根结合口袋或带正电荷的斑块。它通过该结构域不同表面的正电荷结合到 CSA 分子上,这种机制比 DBL3X 更通用。因此,它更有可能在细胞入侵过程中成为完整胞外域的更暴露部分。
这两个结构域具有不同的表面特征,与 CAS 分子相互作用。此外,它们不具有 CSA 结合特异性;相反,它们对碳水化合物的亲和力随着碳水化合物电荷的增加而增加。此外,胞外域显示出强大的配体特异性,其中胞外域作为与 EBA-175 不同的紧凑单体起作用。
结论
碳水化合物结合分子在疟疾病原体的生命周期中至关重要。EBA-175 和 VAR2CSA 都使用相同的 DBL 结构域结合碳水化合物,其中结合的特异性需要多个结构域。EBA-175 同时需要二聚体受体的蛋白质和碳水化合物成分才能实现特异性,而 VAR2CSA 仅需要碳水化合物才能实现特异性;EBA-175 使用“碳水化合物结合表面,排列在二聚化界面处的凹槽中”,而 VAR2CSA 使用“来自单个单体的多个结构域生成一个特定的结合口袋”。对碳水化合物结合蛋白的研究以及对其结构的更深入了解可以为未来的病原体途径以及潜在的治疗靶点提供有用的信息。