结构生物化学/DNA突变
一般来说,DNA序列突变有两种方式。
改变核苷酸碱基: File:Environmental agents damage DNA.jpg环境影响,如紫外线、辐射或有毒化学物质,可以改变核苷酸碱基,使其看起来像其他核苷酸碱基,导致DNA损伤。例如,某些环境因素会改变鸟嘌呤碱基的结构,使其具有类似腺嘌呤的形状。因此,在DNA复制过程中,该“鸟嘌呤碱基”将无法与胞嘧啶结合,而是因为其具有腺嘌呤的形状,它将与胸腺嘧啶结合。
断裂磷酸骨架:环境因素还可以断裂氧和磷酸基团之间的磷酸二酯键。通过断裂基因内DNA的磷酸骨架,可以形成该基因的突变形式。这种突变基因可能会导致功能不同的突变蛋白,并可能导致蛋白质错误折叠疾病。
然而,细胞通常会尝试修复断裂的DNA片段,通过将游离端连接到细胞中的其他DNA片段。这会产生“易位”,另一种类型的突变。如果这种易位断点发生在基因内部或附近,该基因的功能可能会受到影响。
在DNA复制过程中,DNA解旋酶首先将DNA双链分离成两条单链。然后,DNA聚合酶帮助在两个模板链上添加相应的核苷酸,形成两个双链DNA分子。然而,DNA聚合酶在该过程中可能会出现错误,每1亿个碱基发生一次错误。结果是基因突变,这可能导致翻译蛋白的许多功能障碍。
事实上,大多数错误可以在复制过程的后期由一种类型的蛋白质修复。这种蛋白质会用正确的核苷酸替换配对错误的核苷酸。因此,DNA突变的数量实际上更低。
移码突变是由从DNA序列中插入或删除的核苷酸数量(不是3的倍数)引起的。它通常发生在当添加或丢失DNA碱基破坏基因的阅读框架时。阅读框架由三个DNA碱基(密码子)组成,每个密码子代表一个特定的氨基酸。由此产生的蛋白质通常没有功能,因为基因的错误阅读框架从正常的阅读框架翻译出非常不同的蛋白质序列。
例如,具有序列AUG CAG AUA AAC GCU UAA的mRNA的正常氨基酸序列阅读框架应该是:MET GLN ILE ASN ALA STOP。然而,错误的阅读框架(删除第一个碱基'A')会产生mRNA的翻译:UGC AGA UAA ACG CUU AA,异常的氨基酸序列翻译将是:CYS ARG STOP。
在上述情况下,移码突变导致突变后所有密码子的读取都编码不同的氨基酸。停止密码子(“UAA”)无法读取,可以在更早或更晚的位置创建停止密码子。上面创建的蛋白质异常短,包含错误的氨基酸;因此,它没有功能。
移码突变会导致严重的遗传疾病,如泰-萨克斯病,它是由遗传突变导致的酶缺失引起的,这种突变导致神经系统中脂肪物质(神经节苷脂)的积累。然而,移码突变可能是有益的。例如,移码突变导致了尼龙酶的产生,它能够消化尼龙6生产的某些副产品。
另一种可能发生的DNA突变是染色体易位,它是一种染色体异常,由非同源染色体片段的重排引起。在某些情况下,两个分离的基因会连接在一起,形成一个融合基因,这在癌症中很常见。这种融合基因可以在受影响细胞的核型图上检测到。染色体易位主要有两种类型:相互(非罗伯逊)易位和罗伯逊易位。易位也可以是平衡的,其中遗传物质的交换是均匀的,没有多余或缺失的信息,也可以是不平衡的,其中染色体物质的交换是不均匀的,导致多余或缺失的基因。一些由易位引起的疾病包括癌症、不育症和唐氏综合症。
相互易位通常是非同源染色体之间物质的交换。这些易位在很大程度上是无害的,因为交换的遗传物质数量是相同的。它们通常可以通过产前诊断检测到。然而,平衡相互易位携带者有更大的风险产生具有不平衡染色体易位的配子,最终导致流产,甚至导致患有畸形的儿童。
罗伯逊易位最常见于唐氏综合症儿童中。唐氏综合症儿童的父母是导致流产和/或异常后代的不平衡配子的携带者。唐氏综合症儿童易位的情况称为三体性。

倒位是指染色体重排,其中染色体的一部分端到端反转。当单个染色体发生断裂并在自身内重排时,就会发生倒位。倒位有两种类型:臂间倒位和臂内倒位。臂间倒位不包括着丝粒,因此两个断裂都发生在染色体的一个臂上。臂内倒位包括着丝粒,因此每个臂上都有一个断裂点。
倒位通常不会导致携带者出现任何异常,只要排列是平衡的。这意味着没有多余或缺失的遗传信息。然而,那些对倒位杂合的个体会增加异常染色单体的产生,这会导致生育能力下降,因为会产生不平衡的配子。
点突变是指遗传物质DNA或RNA中单个碱基核苷酸被另一种核苷酸替换的突变。点突变通常也包括单个碱基对的插入和/或缺失。点突变可以分为两种类型:
转换:嘌呤碱基被另一种嘌呤碱基替换,或嘧啶碱基被另一种嘧啶碱基替换
颠换:嘌呤碱基被嘧啶碱基替换,或反之
点突变也可以根据功能进行分类:
无义突变:编码终止密码子,可能导致蛋白质截断
错义突变:编码不同的氨基酸
沉默突变:编码相同或不同的氨基酸,但蛋白质的功能没有变化
镰状细胞贫血就是一个错义突变的例子。β-珠蛋白基因发生错义突变,将GAG密码子转换为GTG密码子,编码的是缬氨酸而不是谷氨酸。

插入是指在一个DNA序列中添加一个或多个核苷酸碱基对。这通常发生在DNA聚合酶在微卫星区域滑动时。插入的大小可以变化,一些只包含单个核苷酸碱基对,而另一些则可以是另一个染色体的片段被插入到DNA序列中。在染色体水平上,插入是指将较长的序列插入到染色体中。这通常是由于减数分裂期间不均等的交叉互换造成的。根据插入的方式和内容,可以分为几种不同的插入类型。N区添加是指在末端脱氧核苷酸转移酶的重组过程中添加非编码核苷酸。P核苷酸插入是指插入由重组基因片段末端编码的回文序列。

缺失是指染色体或DNA序列的一部分缺失的突变。缺失是遗传物质的丢失。可以缺失任何数量的核苷酸,从单个碱基对到整个染色体片段。缺失通常是由减数分裂期间染色体交叉互换错误造成的。缺失的一些原因包括易位造成的丢失、染色体内倒位发生的染色体交叉互换、不均等的交叉互换以及断裂未修复。缺失的类型包括端粒缺失和间隙缺失。端粒缺失是指发生在染色体末端的缺失。间隙缺失是指发生在染色体内部的缺失。
小的缺失不太可能致命,而大的缺失则可能更致命,因为丢失的基因总是存在差异。一些中等大小的缺失会导致可识别的遗传疾病。缺失会导致多种遗传疾病,例如男性不育和三分之二的杜氏肌营养不良病例。

扩增是指包含基因的DNA区域的复制,可以作为同源重组错误、逆转录转座事件、整个染色体复制的结果发生。这种复制是由减数分裂期间不均等的交叉互换引起的,发生在排列不整齐的同源染色体之间。扩增通常不构成物种基因组的持久变化,不会持续超过最初的宿主生物体。扩增实际上是基因过表达的一种方式。它可以通过聚合酶链反应人工实现,也可以像刚才解释的那样自然发生。
基因扩增被认为在进化中起着重要作用,这一观点在科学界已经存在了100多年。基因的复制导致了额外的拷贝,该拷贝不受选择压力的影响。新的基因拷贝可以不受有害影响地发生突变。由于不受这些后果的限制,新的基因可以发生突变,这可能潜在地提高生物体的适应性或编码全新的功能。基因复制后存在的两个基因是旁系同源基因,它们通常编码具有相似功能和/或结构的蛋白质。

脱氨基作用是指从氨基酸中去除氨基并将其转化为氨。由于胞嘧啶、腺嘌呤和鸟嘌呤的碱基上都有可以被脱氨基的氨基,因此脱氨基作用会导致DNA突变。例如,如果胞嘧啶在DNA模板链中被脱氨基形成尿嘧啶(尿嘧啶是胸腺嘧啶的类似物),那么聚合酶将在新生DNA链的对应位置插入腺嘌呤而不是鸟嘌呤。胞嘧啶水解反应(脱氨基作用)生成尿嘧啶是自发的。
为了应对这种突变,细胞有一个修复过程。在这个过程中,细胞利用尿嘧啶DNA糖基化酶识别这些尿嘧啶并将其去除。该酶水解脱氧核糖环和尿嘧啶碱基之间的N-糖苷键。因此,尿嘧啶碱基被去除。

由于DNA双链上的这个位点既没有嘌呤碱基也没有嘧啶碱基,因此被称为AP位点(无嘌呤或无嘧啶)。然后,酶AP内切核酸酶切割核苷酸磷酸二酯键3'端的键。在这个阶段,DNA聚合酶I识别下一个核苷酸单元3'端的磷酸二酯键,并将其切割。在去除核糖磷酸单元后,DNA聚合酶I分析互补链,发现与AP位点相对应的碱基是鸟嘌呤。然后,酶在断裂的DNA链上的AP位点插入胞嘧啶单元。最后,DNA连接酶将插入的胞嘧啶连接到受损链中。胞嘧啶自发脱氨基形成尿嘧啶可以被细胞修复。 [1]
快速改变法是一种用于生成位点特异性突变的技术,操作简单。突变位点被整合到两个互补引物中,其余的质粒DNA在热循环仪中用高保真DNA聚合酶合成。因此,整个过程被认为是快速的。
虽然反应是在热循环仪中进行的,但它不是PCR。由于模板是环形的,新合成的单链DNA将在同一链上的引物起始处终止。该产物不会与互补链上的引物重叠。因此,新合成的DNA不能用作进一步DNA合成的模板。只有原始模板DNA可以用作模板。在每个循环中,新合成的DNA量等于模板量。这被认为是线性扩增,而不是PCR中的指数扩增。
由于模板DNA是从细菌中分离出来的,它含有甲基化的核苷酸。这使其对依赖甲基化的核酸酶(如DpnI)敏感。例如,在20个循环的扩增后,10 ng质粒将被扩增20倍,产生200 ng新的DNA。此时,将使用限制性内切酶DpnI来消除原始质粒DNA。然后将DNA混合物放入细菌中,每种DNA物种将在不同的细菌细胞中分离。为了查看一个细胞是否含有正确的突变,需要挑取单个细胞,将其培养,并分析其所含的DNA。引物的设计至关重要。必须满足78°C的最低退火温度。否则,引物将不会与模板结合,终止将不会精确停止。
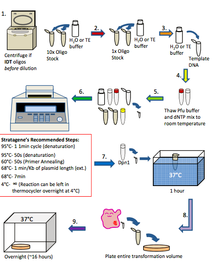
一般来说,快速突变技术按照以下步骤进行。该技术与 PCR 类似。1. 如果寡核苷酸来自 IDT:使用台式离心机以高速旋转寡核苷酸 1 分钟,并用 H2O 或 TE 缓冲液将其重悬至 10 倍浓度(1250 ng/μl)。如果寡核苷酸来自 Allele:用 H2O 或 TE 缓冲液将寡核苷酸稀释至 10 倍浓度(1250 ng/μl)。2. 将寡核苷酸进一步稀释至 1 倍浓度(125 ng/μl),用 H2O 或 TE 缓冲液稀释。3. 将模板 DNA 稀释至 20-50 ng/μl,用 H2O 或 TE 缓冲液稀释。4. 将 10 倍浓度的 pfu 超级缓冲液和 dNTP 混合物解冻至室温。5. 在 100 μl 薄壁 PCR 管中设置快速突变反应:H2O:40 μl、10 倍浓度 PFU 超级缓冲液:5 μl、dNTP 混合物(10 mM):1 μl、模板 DNA(20-50 ng/μl):1 μl、正向引物(125 ng/μl):1 μl、反向引物(125 ng/μl):1 μl、PFU Ultra HF(2.5 u/μl):1 μl,总计:50 μl。6. 轻轻混合 PCR 管中的内容物,并将试管放入热循环仪中。根据实验需要对热循环仪进行编程。7. 反应结束后,将 PCR 管从热循环仪中取出,直接在 PCR 管中加入 1 μl Dpn1,并在 37°C 下孵育 1 小时。8. 使用 2-3 μl 经 Dpn1 处理的 PCR 反应液进行转化(参见转化方案),将整个体积接种到含有与模板 DNA 相对应的抗生素的 LB 琼脂平板上。在 37°C 下培养过夜。9. 次日检查平板上的菌落。如果有菌落,用它们接种 5 ml 过夜培养液,并在次日进行小型制备。将 5 μl 的小型制备 DNA 送去测序并分析结果。
1. Campbell, Neil A. (2005). 生物学. Pearson. ISBN 0-8053-7146-0. {{cite book}}: Check |isbn= value: checksum (帮助); Text "coauthors+ H.C. Van Ness, M.M. Abbott" ignored (帮助)
2. http://www.answers.com/topic/frameshift-mutation http://www.gmilburn.ca/2009/04/03/human-evolution-and-frameshift-mutations/ http://www-personal.ksu.edu/~bethmont/mutdes.html#types
