结构生物化学/酶/不可逆抑制剂
外观
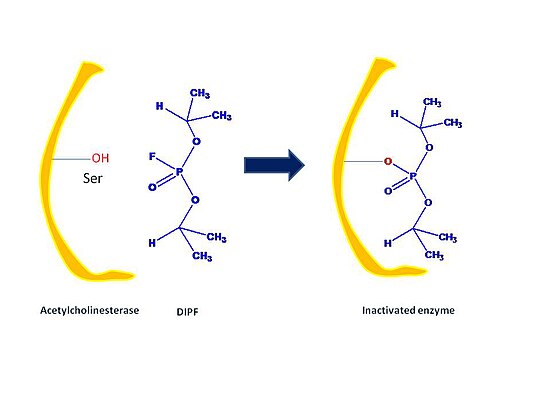
不可逆抑制剂以共价或非共价方式与靶酶结合,并且从酶上解离非常缓慢。不可逆抑制剂有三种类型:基团特异性试剂、活性基团模拟物(也称为亲和标记)和自杀抑制剂。
- 基团特异性试剂与特定的氨基酸侧链反应,例如二异丙基氟磷酸酯(DIPF)和碘乙酰胺。例如,在胰凝乳蛋白酶的28个丝氨酸残基中,只有1个被DIPF修饰。这意味着这个特定的残基特别反应性;此外,这意味着这个特定的残基位于酶胰凝乳蛋白酶的活性位点。DIPF也提供数据表明,通过与活性丝氨酸残基的结合,酶乙酰胆碱酯酶的活性位点确实包含一个反应性丝氨酸残基。DIPF和类似结构的分子对乙酰胆碱酯酶的失活作用代表了一类化合物,被称为神经毒剂。

- 亲和标记(活性基团模拟物)在结构上类似于底物,可以共价结合到活性位点,因此比基团特异性试剂更特异。一个例子是甲磺酰-L-苯丙氨酸氯甲基酮(TPCK),它是一种胰凝乳蛋白酶的模拟物,它结合到活性位点并与组氨酸残基不可逆反应以抑制酶。另一个例子是溴乙酰磷酸酯,它模拟二羟丙酮磷酸酯(DHAP)并共价结合到磷酸三糖异构酶的活性位点,然后修饰酶使其不可逆地抑制。
- 自杀抑制剂(基于机制的抑制剂)与酶结合作为底物,并通过正常的催化机制被加工,产生一个化学反应性中间体,通过共价修饰使酶失活。一个基于机制的抑制剂的例子可以从脯氨酸消旋过程中形成的平面脯氨酸中间体的抑制能力中看出。在这个过程中,形成一个三角形的中间体,消旋酶的形成受到抑制,因为形成产物所需的四面体中间体没有形成。通过平面过渡态的脯氨酸异构化突出了过渡态模拟物作为酶的强效抑制剂的本质。
不可逆抑制是指酶的共价修饰,使得化学反应不可逆;抑制分子对其自身的酶具有特异性,使它们失活,它们通过改变酶的活性位点发挥作用;酶与抑制剂的结合形成可逆的非共价酶复合物,该复合物反应形成另一个不能用于催化反应的复合物。抑制反应可以通过酶和底物或其他可逆抑制剂的可逆竞争而改变。
-
不可逆抑制剂的动力学方案
[1] Berg, Jeremy M., Tymoczko, John L., and Stryer, Lubert. Biochemistry. 6th ed. New York, N.Y.: W.H. Freeman and Company, 2007: 229.

