结构生物化学/酶/酶原

酶原(也称为前酶)是一组蛋白质,也可以描述为无活性的酶。由于它是无活性的前体,因此不具有任何催化活性。这些酶原可以通过化学过程(例如切割、水解)以及其他生化变化来激活,这些变化会切割无活性酶使其活性化。这些生化过程通常发生在溶酶体中,在那里切割会揭示活性位点。活性位点的暴露使酶能够被激活并发挥催化反应的功能。细胞分泌无活性酶的原因是为了防止细胞蛋白质的不必要破坏。只有当条件合适时,酶原才会被激活为酶。有一些专门的酶原细胞,它们只负责以无活性形式合成和储存酶原,准备在身体需要时送往身体的各个部位。
酶原的例子包括
胃蛋白酶原
胃蛋白酶原是胃蛋白酶的无活性前体形式,由胃主细胞分泌。胃蛋白酶原被盐酸(壁细胞分泌)激活,因为盐酸提供了胃蛋白酶最佳发挥作用所需的酸性环境。一旦胃蛋白酶原变成胃蛋白酶,它就负责分解食物。胃蛋白酶原和胃蛋白酶的区别在于,胃蛋白酶原的初级结构额外含有 44 个氨基酸。胃蛋白酶原激活为胃蛋白酶使胃蛋白酶能够进一步催化胃蛋白酶原,将其切割成更多的胃蛋白酶。
胰蛋白酶原
胰蛋白酶原是胰蛋白酶的无活性形式。它由胰腺分泌,存在于胰液中。一旦在十二指肠中被激活,胰蛋白酶就会在赖氨酸和精氨酸的羧基侧切割肽链,除非它们位于脯氨酸之前。胰蛋白酶的重要性在于它能够切割其他酶原,例如糜蛋白酶原和前羧肽酶。
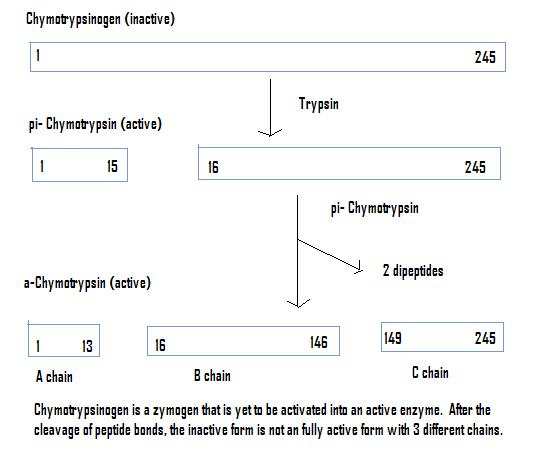
糜蛋白酶原
一旦糜蛋白酶原被胰蛋白酶切割,并与糜蛋白酶反应,就会产生完全活性的酶,糜蛋白酶。糜蛋白酶存在于哺乳动物的消化系统以及其他生物体中。它的作用是切割芳香族氨基酸(色氨酸、酪氨酸和苯丙氨酸)的羧基端的肽。
前羧肽酶
前羧肽酶是羧肽酶的无活性形式,被胰蛋白酶和肠肽酶转化为活性形式。它由胰腺分泌。只有某些形式的羧肽酶最初是以无活性形式产生的。然而,这种机制的优势是确保在消化之前不会立即耗尽酶。
核酸酶
核酸酶是一种能够断裂 DNA 序列中核苷酸之间的磷酸二酯键的酶。核酸酶包含一系列通用酶,例如内切核酸酶。核酸酶在它们切割的 DNA 序列中有所不同,因为某些磷酸二酯键的切割方式可能并不总是完全对称的。
胰淀粉酶
胰淀粉酶是一种在消化过程中将复杂的糖(如淀粉和碳水化合物的多糖)转化为简单的糖的酶。淀粉酶水解淀粉、糖原和糊精,在所有三种情况下都形成葡萄糖、麦芽糖和极限糊精。淀粉酶主要由唾液腺分泌,但也有一些存在于胰腺中,也有助于消化。
脂肪酶
脂肪酶是前脂肪酶的活性形式。一旦被激活,这种水溶性酶就会催化水不溶性脂质底物中酯键的水解。这种作用将脂肪酶归类为酯酶的子类。它将脂肪切割成单甘油酯、脂肪酸和甘油。脂肪酶在几乎所有生物体的消化、运输和处理膳食脂质的过程中也至关重要。
前弹性蛋白酶
前弹性蛋白酶是弹性蛋白酶的无活性形式。前弹性蛋白酶的激活最初是通过简单地切割多个与蛋白质结构中心结构结合的亚基残基来完成的。切割会破坏三级结构的疏水相互作用,从而允许酶的极性区域对消化作出反应。前弹性蛋白酶通过色谱分离与糜蛋白酶不同,因为它揭示了该结构具有高度抗性和通过内部氢键进一步稳定。前弹性蛋白酶和前肽酶用胰蛋白酶激活后,它们的电泳迁移率发生了变化。激活的前弹性蛋白酶与真实的纯弹性蛋白酶以相同的速率迁移。最初高度不溶的前酶可以用氧化铝 Cγ 凝胶处理使其溶解。
肠肽酶
肠肽酶由十二指肠腺体分泌,在小肠壁内产生。这种酶通过蛋白水解作用激活胰蛋白酶原为胰蛋白酶,同时也会激活其他消化酶。肠肽酶在胰蛋白酶原的 C 末端切割,从而激活酶,将胰蛋白酶原转化为胰蛋白酶。大多数肠肽酶由较长链内的二硫键组成,形成催化亚基。
半胱天冬酶
半胱天冬酶是一组半胱氨酸蛋白酶,在细胞凋亡、坏死和炎症中起着至关重要的作用。半胱天冬酶在细胞中在发育过程中以及成年生命中的其他阶段的细胞凋亡(程序性死亡)中起着重要作用。半胱天冬酶也称为“执行者”蛋白,因为它们在细胞中起着这种作用。
凝血酶原
凝血酶原(酶原)是凝血酶的先驱,凝血酶反过来将纤维蛋白原转化为纤维蛋白。纤维蛋白是负责血液凝固和组织破裂期间组织修复的蛋白质。纤维蛋白原是凝血酶的底物,当被凝血酶激活时,它会变成纤维蛋白,一种不溶性糖蛋白。纤维蛋白原具有线性对称结构,包含一个中心切割位点,在两端都有一个被称为球状单元的东西,它位于一个指定的 α 区域之后。球状区域有两个“连接位点”β 和 γ。这两个位点能够连接到另外两个纤维蛋白蛋白,这使得蛋白质能够连接并形成网格状结构,使其成为一种坚固的结构,称为交联纤维蛋白凝块。
[[Image:File:Commonpathway.png
血管紧张素
血管紧张素是一种寡肽,它会导致血管收缩和血压升高。它还会刺激肾上腺皮质释放醛固酮。它是一种激素,也是一种强效的促渴剂。