结构生物化学/膜蛋白/膜蛋白组装成复合物
嵌入膜内的蛋白质(整合蛋白)在细胞内执行许多至关重要的功能,数据表明膜蛋白在复合物中发挥作用。研究人员一直在努力确定这些膜蛋白相互作用的因素。只有有限数量的膜蛋白与目前用于研究膜蛋白在复合物中功能的方法兼容,并且对此主题的了解很少被可靠地报道。科学家仍在努力确定膜蛋白复合物的组成。
然而,即使面对这些困难,也存在一些方法,帮助研究人员在分析某些膜蛋白复合物方面取得了一些进展。特别是,线粒体、微粒体、细菌和叶绿体的膜蛋白复合物已通过蓝原生聚丙烯酰胺凝胶电泳 (BN-PAGE) 进行检查。此外,还利用分裂泛素方法分析了酵母膜蛋白相互作用。
除了确定膜蛋白复合物的组成,了解这些复合物中组装过程的活力也很重要。组装是一个有序的过程,这对复合物的整体功能至关重要。较大的蛋白质复合物需要更多中间体,在这种情况下,识别这些中间体的性质要困难得多。在更简单的复合物中,科学家们已经能够确定组装顺序过程和所涉及的中间体。这些特定的组装顺序在确定执行特定细胞功能所需的特定途径方面起着重要作用。对于不同的组装顺序,该途径可能会导致系统过程中的“死胡同”。
这些“更简单的复合物”之一的良好例子是经过研究的大肠杆菌细胞色素 bo3 复合物。该复合物的线性组装途径是通过发现该复合物是如何由四个整合亚基蛋白组成的,并由两个中间复合物组装而来的。大肠杆菌也证明了“有序组装”中顺序的活力。为了使该复合物内的细胞分裂过程正常发挥功能,必须将 12 个蛋白质依次导入分裂位点,并且它们必须以正确的顺序进行排列,否则正确的细胞分裂将无法发生,并且潜在的有害中间复合物可能会从组装顺序错误产生的错误途径中产生。
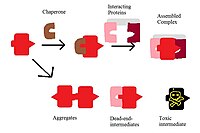
膜蛋白复合物功能中一个非常重要的因素是协调其组装的伴侣蛋白。这种伴侣蛋白可以与组装的蛋白质复合物相互作用,并通过阻止不必要的相互作用来指导它们实现最终的功能目标。不想要的膜蛋白复合物相互作用可能会导致潜在的有害且无功能的复合物。这些不想要的蛋白质在左边的图中显示出来。因此,如果没有伴侣蛋白,蛋白质可能会聚集、停滞在死胡同中间体或变得剧毒。伴侣蛋白的一个例子是 F1F0-ATP 合酶中 F1 的组装。这是一种酵母酶,由 α 和 β 亚基组成。组装因子 Atp12p 和 Atp11p 通过与亚基的疏水表面结合并将它们移动到 α3β3 复合物中来防止组装变得聚集。F0 的形成也使用名为 UncI 的伴侣蛋白。UncI 伴侣蛋白引导 c 亚基的组装,c 亚基形成同聚体的 c 环。在没有 UncI 伴侣蛋白的情况下,c 亚基仍然能够与 F0 机械的其他部分组装;然而,如果没有 UncI,它就不能形成 c 环,形成的复合物将是一个最终无法发挥功能的“死胡同”中间体。
此外,伴侣蛋白还介导负责调节复合物形成的过程。在某些情况下,当组装过程中涉及多种蛋白质和界面时,会以伴侣蛋白贡献的选择性方式进行。某些相互作用可能发生在复合物形成的后期阶段,而不是之前看到的中间阶段;伴侣蛋白在该调节中发挥作用。在对红杆菌中的 cbb3 型细胞色素 c 氧化酶的研究中,研究人员发现复合物组装是通过一个非活性后期组装中间体(由三个结构亚基和两个组装因子组成)发生的。在过程结束时,只有当最后一个结构亚基取代了先前存在的组装因子时,复合物才被激活。人们认为,这些非活性中间体可能在复合物组装过程中至关重要,在该过程中,不完全的复合物组装会产生有害后果,例如呼吸或光合作用复合物组装。
最近的研究也致力于研究组装蛋白质中的动态交换。这种动态交换允许这种膜蛋白轻松地进出它们所属的复合物。动态交换提供了一种修复方法:如果复合物的部分受损,则不会使整个复合物变得无用或无功能,而是可以将该特定蛋白质替换为功能正常的蛋白质。根据这项研究,膜蛋白形成后并不稳定。早期的研究表明,叶绿体中光系统 II 的蛋白质通过用新的 D1 亚基交换光损伤的 D1 亚基来修复。动态交换的另一个例子涉及线粒体外膜复合物的转运蛋白。这种实验表明,蛋白质仅被运送到线粒体中,因此它们不会拾取完成复合物合成所需的任何其他必要亚基。虽然这为蛋白质组装带来了一个新的令人兴奋的事实,但它只在体外或试管中得到直接证明,而不是在体内得到证明。然而,最近的三项研究对含有 GFP 标记蛋白的细胞进行了荧光显微镜观察,显示了体内动态交换。

