结构生物化学/有机化学

研究含碳分子的科学被称为有机化学。 碳原子使生命成为可能的特性之一是它能够与其他原子(包括其他碳原子)形成四个共价键。 这种结合能力源于碳原子外壳中的四个电子,使其需要另外四个电子才能使外壳充满。
在生物体中,碳原子最常与其他碳原子以及氢、氧、氮和硫原子形成共价键。 在有机化合物中,两个碳原子之间、碳和氧之间或碳和氮之间的键可以是单键或双键。 然而,在无机化合物中可以发现这些原子之间更高阶的键。 碳与自身以及不同元素和不同类型的键的组合使得仅从几种化学元素就能形成大量的有机化合物。 这更加令人印象深刻,因为碳键可能以线性、环状或高度分支的构型存在。 这些分子形状可以产生具有多种功能的分子。 碳在生物化学中重要的最后一个特征是碳键在与生命相关的不同温度下都很稳定。 这种性质部分源于碳原子与大多数其他原子相比非常小,因此形成碳-碳键的碳原子之间的距离相当短。 两个大原子之间形成的较短键往往比较长的键更强更稳定。 因此,碳原子与我们今天观察到的生命相容,即生物体可以抑制从地球冰冷的两极到深海热液喷口的各种环境。 除最简单的烃外,大多数有机分子和生物大分子都含有官能团 - 一组具有特殊化学特征的原子,这些特征在功能上很重要。 每种类型的官能团在所有包含它的分子中都表现出相同的特性。 例如,氨基(NH2)充当碱。 在生物体中发现的 pH 值下,氨基很容易结合 H+ 成为 NH3+,从而从水溶液中去除 H+ 并提高 pH 值。
在有机反应中合成新的碳-碳键是一项重要的有机合成技术,它导致了人工化学品的生产,例如新药和塑料。 在羰基化学中,许多合成技术基于生物系统中形成碳-碳键的自然过程。 形成新的碳-碳键的有机反应的一些例子包括醛醇缩合反应、克莱森缩合反应、狄尔斯-阿尔德反应和迈克尔反应。

醛醇缩合反应是一种在有机化学中形成新的碳-碳键的强大技术,因为它将两个简单的分子联合成一个复杂的分子。 该反应将两个羰基化合物结合在一起,形成一个新的 β-羟基羰基化合物。 这种反应的产物被称为醛醇,被称为醛 + 醇的产物。 典型的醛醇缩合反应涉及酮烯醇负离子对醛的亲核加成。 当醛醇产物失去一个水分子形成 α,β-不饱和羰基化合物时,就会发生醛醇缩合反应。 可用于醛醇缩合反应的亲核试剂包括酮、醛和其他带有羰基官能团的化合物的烯醇、烯醇负离子以及烯醇醚,而亲电试剂通常是醛或酮。 当使用不同的亲核试剂和亲电试剂时,该反应被称为交叉醛醇缩合反应。 另一方面,使用相同的亲核试剂和亲电试剂的反应被称为醛醇二聚化。

克莱森缩合反应发生在两个酯或一个酯和另一个羰基化合物之间,在强碱的存在下,生成 β-酮酯或 β-二酮。 在克莱森缩合反应中,酯烯醇负离子对羰基的进攻会生成一个新的碳-碳键。 该反应机理包括通过用具有酯官能团的试剂与乙酸乙酯反应生成酯烯醇负离子,另一个酯分子的亲核加成产生酮酯,烷氧基的消除,最后是酮酯的去质子化,然后在水性后处理中质子化。 整个过程是吸热的,去质子化酮酯之前的步骤都是可逆的。 酮酯的去质子化驱动平衡,因为它去除了催化先前步骤所需的碱。 为了防止酯交换,烷氧基和酯通常都衍生自相同的醇。

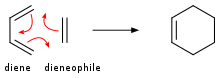
在狄尔斯-阿尔德反应中,共轭二烯与取代的烯烃加成,生成取代的环己烷衍生物。 这种反应是π体系之间环加成反应的特例;包含四个π电子的四个共轭原子与包含两个π电子的双键反应。 四碳组分称为二烯,添加的烯烃称为亲二烯体。 该反应也称为 [4+2] 环加成反应。 这种类型的反应仍然可以在新形成的环中没有碳的情况下进行。 可逆的狄尔斯-阿尔德反应称为逆狄尔斯-阿尔德反应;例如,环状体系的分解反应。
迈克尔反应是碳负离子或其他亲核试剂对α,β-不饱和羰基化合物的亲核加成。 由β-二羰基化合物与α,β-不饱和羰基化合物衍生的稳定负离子会导致 1,4-加成。 它是用于温和形成新的碳-碳键的最有用的方法之一。 迈克尔加成反应是碱催化的,适用于 α,β-不饱和酮、醛和其他羧酸衍生物;它们被称为迈克尔受体。 迈克尔供体是亲核试剂上的吸电子基团,如酰基和氰基。 [Vollhardt] [1]

有机分子也存在异构体。 异构体是具有相同原子数和相同原子类型的分子。 但是,它们的键合方式不同。 异构体的类型包括结构异构体(或结构异构体)和立体异构体。
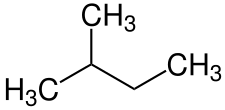
结构异构体(结构异构体)是指具有相同分子式但原子排列和连接方式不同的化合物。 链状异构体、位置异构体和官能团异构体都是结构异构体。
链状异构体
例如:戊烷和 2-甲基丁烷
位置异构体
例如:3-己酮和 2-己酮
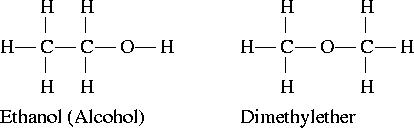
官能团异构体
例如:乙醇和二甲醚
立体异构体包括构象异构体和构型异构体。 构象异构体是指具有相同分子式和原子连接性但围绕键旋转不同的化合物。 换句话说,构象异构体可以通过围绕单键的旋转相互转化。 它们在室温下无法分离。 存在不同类型的构象异构体。 它们是重叠、交叉、反式和邻位构象。 构型异构体是指只能通过断裂键才能相互转化的异构体。 存在两种不同类型的构型异构体。 它们是 enantiomers 和 diastereomers。 对映异构体是非对映体的镜像。 非对映异构体是非对映体的非镜像。
葡萄糖和果糖,尽管它们的化学式都是 C6H12O6,但原子排列方式不同,是结构异构体的典型例子。对映异构体则是立体异构体的一种。立体异构体是具有相同原子间键合方式,但在空间排列上不同的异构体。例如,对映异构体是彼此的镜像。它们可以重叠(非手性)或不能重叠(手性),并且可能表现出 R(顺时针)或 S(逆时针)构型。手性分子的每个镜像与其对应物表现出不同的性质。判断一个分子是否手性的一种方法是寻找和识别手性中心。碳的手性中心有四个不同的基团与之相连。它必须是 sp3 杂化的,并且呈四面体形状。一个分子的手性中心也可以称为立体中心。
富勒烯是有机分子,仅由碳原子组成。
有机合成是构建分子的科学。有机合成研究主要有两个领域:探索性研究和目标导向型研究。这两个领域的研究都需要创新、想象力和艺术创造力。
探索性研究涉及开发新的有机反应。该领域许多研究人员专注于优化已知反应。开发新的有机反应有很多因素,例如反应物、溶剂、温度、pH 值等。该领域任何研究人员的主要目标是最大限度地提高目标产物的产率,最小化副反应/副产物,并且能够可靠地用于各种起始原料。有机合成方法学方面的进步扩展了目标导向型研究中使用的工具和技术。
目标导向型研究涉及通过一系列有机反应开发有机分子。该领域的研究人员利用现有的反应和市售材料合成目标产物。“目标”分子可以是天然产物或设计分子。对于简单的分子,线性合成(一个接一个地进行的线性反应系列)就足够了。对于复杂的分子结构,采用其他方法,例如收敛合成(关键中间体的独立合成)。固相合成等方法在蛋白质合成中非常有用。
“目标”分子是生物学上、医药上或理论上有趣的产品。生物有机合成领域始于 1828 年弗里德里希·维勒合成尿素。天然产物合成曾多次获得诺贝尔化学奖。目标导向型天然产物对医学研究非常有用。在多种天然产物中,包括海洋天然产物中,都发现了抑制癌症的分子。
新的反应不断被开发和优化。许多反应在药物和生物标志物的合成中特别有用。钯交叉偶联反应等反应,该反应获得了 2010 年诺贝尔化学奖,在药物、生物标志物和其他有用分子的合成中非常有用。
最简单的铃木偶联反应涉及苯硼酸和溴苯的钯交叉偶联反应,生成联苯。
在过去几十年中,偏离传统合成方法带来了分子构建技术替代方法的巨大进步。固相合成是一种创新技术的例子,该方法将分子构建单元连接到珠子上,并通过一系列线性反应物溶液获得“目标”分子。与传统的溶剂型合成相比,固相合成有几个优点。一些优点是功能基团可以很容易地被保护,而且更容易从目标“目标”分子中提取不需要的副产物或反应物。固相合成在肽、脱氧核糖核酸 (DNA) 和其他基于序列的分子合成中非常有用。
“有机合成中充满了兴奋、冒险和挑战,而且它可以成为伟大的艺术”——R.B.伍德沃德(1965 年诺贝尔奖获得者)
在肽合成中使用偶联剂是活化一个氨基酸的羰基碳的一种方式,从而使其对相邻氨基酸的胺基更具反应性。二环己基碳二亚胺和各种脲盐在该领域中主要用作偶联剂 [1]。虽然使用偶联剂并不是一项艰巨的任务,但构建一个内在活化的氨基酸将绕过这些试剂的使用,从而节省时间、金钱和反应产率。
本文将描述获得活化氨基酸的一般合成方法。特定异腈与任意醛反应生成 α-羟基吲哚类物质 [2]。

将该物质上的羟基转化为氨基将生成活化的氨基酸。请注意,吲哚功能是芳香稳定的,作为一个很好的离去基团,从而活化羰基碳。重要的是,转化后的胺功能需要被保护,以防止单体之间的交叉反应。完成这项任务并不容易,因为许多化学合成需要极端条件,不适合肽合成。高温或 pH 值波动很容易破坏肽键,导致目标肽被破坏。因此,人们希望在进行这种置换时使用温和的条件。[2] [Gianneschi]
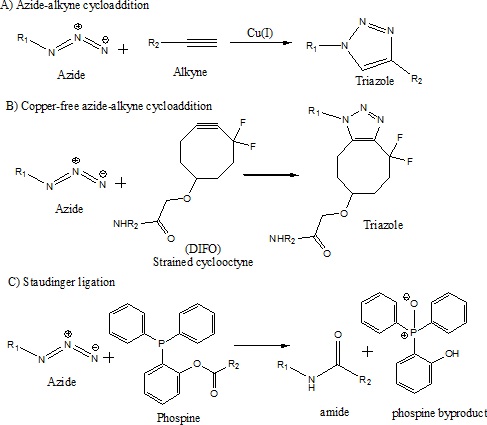
能够以高选择性生成分子修饰对于化学和生物体系的研究非常宝贵。点击化学是化学哲学,它利用 Sharpless、Finn 和 Kolb 在 2001 年开发的一组高效反应合成分子。点击化学发展的灵感来自于大自然往往从较小的亚基产生物质的想法。点击化学背后的逻辑是用小分子单元结合在一起,用反应快速生成产物,这些反应在环境条件下以高产率进行。这些反应需要具有很高的热力学驱动力,并且与生物分子中可能存在的其他官能团正交。点击化学反应对标记生物分子很有效。它们还在生物条件下以高产率进行。反应的一个重要方面是它们是生物正交的,这意味着它们不会与生物体系中的官能团发生反应。点击化学反应的一些例子是(a)叠氮化物-炔烃环加成、(b)无铜叠氮化物-炔烃环加成和(c)斯陶丁格连接,如下面的方案所示。
点击合成的主要目标是简化分子合成方法,从而改善识别和合成具有生物学重要性的分子的过程。这些方法已被证明对现代药物开发有利;对原位片段基础药物设计特别有用。通过点击化学进行原位药物开发已扩展到选择性生成强效的碳酸酐酶和 HIV-1 蛋白酶抑制剂。下面显示了利用点击化学进行抑制剂开发过程的示意图。
这些技术在组合药物开发中非常有用。叠氮化物-炔烃环加成的产物三唑在药物设计中是很有利的,因为它具有多种有用的性质。这些反应高度调节的性质,具有高产率、选择性以及能够在温和(生物)环境中进行转化,使得产物能够直接分析其活性,而无需纯化(这是一个重要的捷径!)。下面显示了点击化学产物与 α-1,3-岩藻糖基转移酶 (fuc-T) 直接筛选的例子。
点击化学设计包括与生物分子反应相反的反应。这对于选择性地标记分子以在生物体系中检测非常有用。斯陶丁格连接和叠氮化物-炔烃环加成已被证明对以前非常具有挑战性的任务非常有用。
有广泛的应用范围,下面简要描述和示例示意图:
(1) 将带有反应性标签的非天然氨基酸引入蛋白质。
(2) 标记病毒表面。
(3) 通过翻译后修饰将标记探针掺入蛋白质。
(4) 标记核苷酸以成像 DNA 和 RNA。
(5) 脂质探针的衍生化。
(6) 基于活性的蛋白质谱分析。
从化学生物学中的广泛应用可以清楚地看出这些方法的优势。这些反应的范围相当广泛,使用这些方法的研究人员的创新发挥了其最大潜力。这些方法也扩展到纯有机化学实验室。在没有生物环境的限制的情况下,这些反应在精确控制目标结构方面具有明显的优点。生物正交化学的进展(已经并)继续为未来的研究提供新的有效工具。[最佳]
维勒合成是合成反应的一个例子,在该反应中,分子被制造出来。在这个反应中,碳化合物,有机产物,是由无机盐制成的。
Pb(OCN)2 + 2 H2O + 2 NH3 -----> 2 H2N(C=O)NH2 + Pb(OH)2
氰酸铅 水 氨 尿素 氢氧化铅
正常人的胃每天大约含有 0.02 M 的 HCl。如果胃中 HCl 增加,胃液的 pH 值会从 2.5 降至 1.0。HCl 会破坏食物中蛋白质分子的正常折叠形状。结果,酸会破坏胃中的许多消化酶。因此,为了保护自身免受这种酸增加的影响,胃中的细胞必须共同努力来防止这种情况发生。首先,胃组织由蛋白质分子构成,内部覆盖着胃粘膜层。当闻到和尝到等刺激激活胃粘膜中的细胞时,信号分子组胺会使壁细胞隐藏胃中的酸性汁液。结果,胃中酸性汁液的产生会增加。为了防止这种情况发生,西咪替丁、法莫替丁和雷尼替丁等活性成分通过阻断组胺帮助壁细胞,从而帮助减少酸。 [2]
http://en.wikipedia.org/wiki/Claisen_condensation
http://en.wikipedia.org/wiki/Aldol_reaction
http://en.wikipedia.org/wiki/Claisen_condensation
http://en.wikipedia.org/wiki/Diels%E2%80%93Alder_reaction
http://en.wikipedia.org/wiki/Michael_reaction
Vollhardt and Schore. Organic Chemistry. 第 6 版。纽约:W.H. Freeman and Company
http://en.wikipedia.org/wiki/Carbon%E2%80%93carbon_bond
http://en.wikipedia.org/wiki/Peptide_synthesis
Gianneschi, C. N., Rubinshtein, M., James, R.C., Kobayashi, Y., Yang, J., Young, J., Yanyan, J.M. Org. Lett., 2010, 12 (15), pp 3560–3563
Best, M.D. Biochemistry, 2009, 48 (6571), pp 6571–6584
- ↑ Vollhardt,Peter 和 Schore,Neil。(2009)。有机化学第 9 版。W.H. Freeman and Company。 ISBN 978-1-4292-0494-1。
- ↑ Vollhardt,Peter 和 Schore,Neil。(2009)。有机化学第 9 版。W.H. Freeman and Company。 ISBN 978-1-4292-0494-1。