结构生物化学/有机化学/有机分子机制
费歇尔酯化反应是一种可逆反应,反应物是醇和羧酸。在酸催化下,羧酸被质子化并转化为活化的亲电试剂。醇作为亲核试剂,由于氧原子对电子的吸引作用而带正电,因此会攻击羰基碳。这种攻击的结果是形成了四面体中间体。一旦形成了中间体,原来的羧酸上的醇基团会发生去质子化,而羟基会发生质子化。当羟基发生质子化时,由于羧基的离域电子,该官能团被除去,导致一个水分子的去除,最终产物是酯。由于平衡机制,费歇尔酯化反应机制中提到的所有步骤都可以逆转,这对于获得最终的酯产物是不利的。勒夏特列原理可以用来控制反应,使酯的生成比逆反应更有利。为了实现这一点,可以加入过量的羧酸或醇,同时除去反应正反应中产生的副产物水。
当一个化学反应被引入时,通常只显示反应物和产物。在下面显示的例子中,通常会将酯显示为起始原料,连同它的产物羧酸一起。我们的任务是描述发生在反应中的整体转化,在下面的例子中——水解。在下面显示的例子中,酯能够通过一系列反应中间体水解成羧酸。对于有机机制来说,我们的任务是研究键是如何以及何时断裂和形成的,以及底物的不同变化如何影响反应的结果。

步骤 1: 催化:碱攻击羰基碳,将双键上的电子推向氧原子。
步骤 2: 离去基团:氧阴离子的电子重新形成双键,将旧的酯基团踢出,完成水解。
步骤 3: 去质子化:如果亲核试剂是 OH- 基团,那么氢原子就会被去质子化。

步骤 1: 催化:羰基氧原子被酸催化剂质子化。
步骤 2: 亲核攻击:亲核试剂攻击羰基碳,将双键上的电子推向氧原子。水分子中的氧原子在亲电攻击羰基碳时起着亲核试剂的作用。这形成了一个四面体中间体。
步骤 3: 分子内质子化:原来的 -OMe 基团从新加入的水基团上得到一个质子。这种质子化使 -OMe 成为一个好的离去基团。
步骤 4: 水解:羟基的电子向下移动,形成双键,从而将旧的酯基团踢出。
步骤 5: 去质子化:溶剂从新形成的双键氧原子上去掉一个质子。羰基氧原子的去质子化导致酸催化剂的再生。这将导致最终产物。
这展示了有机化学中使用的一种机制的例子。对有机分子的性质和其键合性质的良好理解,使我们能够预测反应机制。
上面的图像显示了酯键断裂并被另一个酯基团取代。
下面,您将找到相同的机制,但没有重新形成新的酯键,也就是所谓的酯交换反应 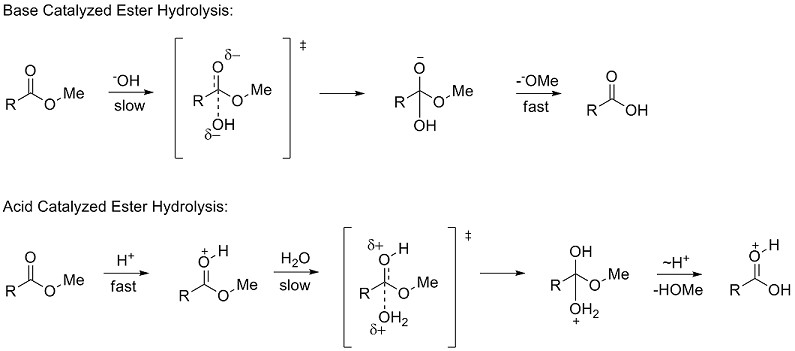
酮和烯醇互变异构体在酸性或碱性条件下处于平衡状态。烯醇是烯醇类化合物的简称,而酮则是酮的简称。在从酮到烯醇的过程中,会形成烯醇负离子,这是带有电荷离域在氧和碳上的共振结构。酸催化反应和碱催化反应都非常快,并且酮形式在溶液中更容易被发现。[1]
步骤 1: 质子化:烯烃攻击酸性溶液中的游离酸性氢质子。
步骤 2: 缓解电荷:醇中的孤对电子向下移动,以缓解碳上的正电荷。
步骤 3: 去质子化:然后,生成的羰基化合物被去质子化,最有可能来自溶剂或水。
请注意,在酸性条件下,从酮到醇的反应是相同的机制,但方向相反,其中羰基被质子化,然后从碳上去掉一个质子,留下电子形成烯烃。[1]
步骤 1: 去质子化:碱从醇基团上去掉一个氢质子。
步骤 2: 共振:共振结构表明负电荷可以在碳上得到一定程度的稳定。
步骤 3: 重新质子化:带负电的碳然后拉入一个氢质子,最有可能来自碱或溶剂。
请注意,在碱性条件下,从酮到醇的反应是相同的机制,但方向相反,其中碱会拉掉氢原子形成烷氧负离子中间体,然后从碱中重新得到氢原子。[1]
羟醛缩合反应是指烯醇负离子攻击羰基官能团形成碳-碳键。羟醛这个名字来源于醛醇。羟醛缩合反应可以用酮和醛进行,可以是相同的醛/酮作为起始烯醇负离子,也可以是不同的醛,这被称为交叉羟醛缩合反应。它是一种缩合反应,因为它会释放水。此外,还要注意,它会再生一当量的所用碱。[1]
步骤 1: 烯醇负离子形成:碱(本例中为氢氧化物)去质子化一个氢原子,形成具有两个共振结构的烯醇负离子。
步骤 2: 烯醇负离子攻击:带负电荷的碳原子攻击第二个醛(或酮)的羰基碳。请注意,烯醇负离子烷氧负离子在负电荷方面比碳原子更稳定,因此共振结构被用来准确地描绘将要形成的碳-碳键。
步骤 3: 质子化:烯醇负离子攻击后形成的烷氧负离子随后被质子化,从而得到最终产物。请注意,碱被再生了。
与其他亲核试剂类似,烯醇负离子可以通过迈克尔加成反应,对α,β-不饱和醛或酮进行共轭加成,形成碳碳键。与之前一样,首先形成烯醇负离子,然后该碳原子会进攻第二个反应物中的碳原子,该反应物具有与羰基共轭的双键,被称为迈克尔受体。这与羟醛缩合的反应机理类似。[1]
步骤 1: 烯醇负离子形成:像氢氧化物这样的碱会从碳原子上去质子化,形成烯醇负离子。
步骤 2: 烯醇负离子进攻:烷氧基将额外的一对孤对电子推向羰基,使羰基重新形成,碳原子会攻击迈克尔受体的共轭碳原子。在两个反应物通过碳碳键融合在一起后,会发生一系列电子推动链反应,形成另一个烷氧基。
步骤 3: 质子化:新形成的烷氧基随后会被溶剂或水质子化。
[1] Vollhardt, Peter 和 Neil Schore. 有机化学:结构与功能. 第 6 版. 纽约: W. H. Freeman and Company, 2011.
