结构生物化学/有机化学/鉴定方法

薄层色谱 (TLC) 有助于确定混合物中化合物的组成,以及区分两种化合物。在 TLC 中,涂有薄层吸附剂的玻璃、金属或塑料板充当固定相,纯溶剂或混合溶剂充当流动相。大多数非挥发性固体有机化合物都可以通过 TLC 进行分析。要进行 TLC 实验,将少量待分离的混合物溶解在合适的溶剂中,并将其点在 TLC 板一端附近。然后将板放置在一个封闭的室中,最靠近点迹的边缘浸入一层称为展开剂的流动相中。然后让溶剂通过毛细作用上升到固定相中。随着溶剂上升到板中,样品在流动相和固定相之间分配,由于两相之间以及待分离化合物之间的极性不同而分离。化合物极性越强,与吸附剂结合越紧密,在 TLC 板上移动越慢。展开剂使非极性物质最迅速地向上移动到板上,而极性物质向上移动得更慢。当溶剂前沿距顶部约 1 厘米时,取出 TLC 板并标记其位置。Rf(保留前沿或相对于前沿的比例)可以根据化合物相对于基线移动到板上的距离计算得出。Rf = 化合物移动距离 / 溶剂前沿移动距离。该值的范围可以从 0 到 1。Rf 为 0.2 通常是理想的。但是,可以通过改变流动相中使用的溶剂的极性来调整该值。然后在通风橱中干燥板,并使用可视化方法来分析板。
为了更好地理解此过程背后的基本原理,将薄层色谱放大到我们经常看到的物体尺寸会有所帮助。
想象一下
固定相是海滩
流动相是拍打海岸然后返回海洋的波浪。
化合物是不同质量的人
最初,两个不同质量的人坐在海滩上的同一个位置。当波浪拍打到他们的位置时,它会将体重较轻的人拉到海里。随着时间的推移,由于对沙子的吸引力不同,体重较轻的人会与体重较重的人拉开距离。他们从初始位置移动的距离是不同的,可以作为这两个人的特征和分离因素。尽管在薄层色谱中,流动相在一个方向上移动,化合物不一定按质量不同,而是按其对固定相和流动相的亲和力差异不同,但这个例子有助于理解这个重要过程的基本概念,用于识别和分离混合化合物。
固定相结合的固体载体可以由玻璃、塑料或铝板制成。用于制造固定相的最常见化合物是硅胶。由于它具有多孔性,因此具有很大的表面积,这有助于与化合物进行理想的广泛相互作用。固定相必须结合到所选的固体载体上。这可以通过将硅胶与有助于硅胶颗粒粘附到固体载体的化合物混合来实现。然后将制备好的混合物涂抹到固体载体上并使其干燥。
有两种简单而基本的可视化方法,即荧光和碘可视化。荧光涉及使用含有荧光指示剂的吸附剂。然后,在暗箱中使用短波长紫外灯照射板的吸附剂侧时,检测出不溶性无机指示剂。分离的化合物在荧光场中显示为深色斑点,因为形成斑点的物质通常会淬灭吸附剂的荧光。这些斑点随后可以进行分析。另一种可视化无色有机化合物的方法是使用它们对碘蒸汽的吸附。这是通过将板放置在碘蒸汽浴中来实现的。物质与碘蒸汽的反应逐渐产生彩色斑点。斑点在白色到棕褐色的背景上呈深棕色。10-15 分钟后,可以取出板,并用铅笔勾勒出斑点,因为斑点经常在以后分析之前消失。
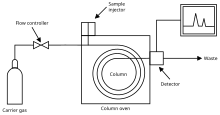
气相色谱 (GC) 可以快速评估化合物的纯度,但不能仅凭自身识别化合物,除非有已知相同化合物可用作标准。通过比较保留时间、峰值增强和色谱图,可以确定混合物组分的身份。GC 对混合物组分的定量分析非常有用,因为色谱图上相对峰面积的比较通常可以很好地近似每种化合物之间的相对含量。
气相色谱的工作原理本质上是让两个相彼此作用。流动相,换句话说,是“移动相”,由惰性气体(如氦气)或非反应性气体(如氮气)来实现。固定相是液体或聚合物的微观层,它被支撑在放置在称为柱子的玻璃管内的惰性固体上。混合物中待分析的气态化合物与涂有固定相的柱壁相互作用。由于各种化合物在固定相中显示出不同的极性和亲和力,因此根据化合物在固定相中结合的时间来计算保留时间,而流动相向上移动到固定相中。各种化合物不断地与固定相和流动相结合,并通过它们与固定相之间相互作用强度的差异来分离。保留时间的比较显示了气相色谱仪的效率和应用。
红外光谱是**有机化学**中最实用的光谱技术之一,因为它是一种快速有效的方法,能够识别化合物中是否存在简单官能团。当红外能量通过样品时,会观察到吸收带,这些吸收带与化学键类型相关联,可以提供有关样品中官能团性质的重要信息。红外光谱以吸收强度的函数绘制能量(以频率或波长表示)。这是分子振动的结果。组成分子的原子处于不断运动中,原子相对于彼此的运动可以被描述为振动。被有机化合物吸收的红外辐射光子具有恰好足以拉伸或弯曲其共价键的能量。由于这种振动,红外光谱中出现吸收带。这些带受到化合物不同振动模式、极性和键级的影响。在四面体碳中,存在不同类型的振动模式。它们分别是伸缩、弯曲、剪刀式、摇摆、扭转和摆动。对于伸缩,它可以是对称的或非对称的。
非对称伸缩
对称伸缩
弯曲
剪刀式
扭转
摆动
**红外光谱形成原理** 中红外区域为有机化学家提供了最多的信息。该区域从 4000 cm-1 到 600 cm-1。大多数有机分子简单官能团的吸收出现在该区域。红外光谱以官能团的波数(频率的倒数)为横坐标,以吸收强度为纵坐标。通过在红外光谱仪中运行感兴趣的样品来实现这一点,当识别出某个官能团时,光谱上会出现一个峰。波数对应于官能团吸收能量的频率,强度衡量官能团吸收的强弱。由于构成分子的原子处于不断运动中,因此它们被称为“振动”。当这些基团从它们遇到的光子中吸收恰当的能量时,分子将获得足够的能量来拉伸或弯曲它们的共价键。拉伸和弯曲是两种不同的振动类型。分子的分子振动能级是量子化的,这意味着振动只有在红外能量与分子振动频率完全匹配时才会发生。如果能量不匹配,则不会发生吸收。因此,如果不存在官能团,红外光谱上就不会出现吸收峰,这使得红外光谱成为识别分子中官能团的非常强大的工具。此外,键级可以提供有关某些峰在红外光谱中出现位置的额外信息。键级是指两个分子之间发生的键合量。从烷烃到烯烃再到炔烃,碳原子之间的键级增加。键级随着两个成键原子之间键的数量增加而增加。原子键级越高,分子吸收的波数越高,产生伸缩振动所需的能量也越大。原子质量也提供有关某些分子在红外光谱中吸收位置的信息。振动原子的原子质量越大,频率越高,拉伸分子键所需的能量也越大。
**识别红外光谱上的官能团** 通过使用红外光谱仪进行的许多实验,科学家们已经找到了某些官能团和键的伸缩发生的区域。下表显示了这些区域。
| 键或官能团 | 波数 (cm−1) |
|---|---|
| RO — H (醇) | 3200 - 3650 |
| RC(=O)O — H (羧酸) | 2500 - 3300 |
| R2N — H (胺) | 3250 - 3500 |
| RC=C — H (炔烃) | 3260 - 3330 |
| C=C — H (烷烃) | 2840 - 3000 |
| C—H (烷烃) | 2840 - 3000 |
| RC=CH (炔烃) | 2100–2260 |
| RC=CN (腈) | 2220–2260 |
| RC(C=O)H (醛, RC(C=O)R’ (酮) |
1690–1750 |
| RC(C=O)OR’ (酯) | 1735–1750 |
| RC(C=O)OH (羧酸) | 1710–1760 |
| -C=C- (烯烃) | 1620–1680 |
| RC — OR’ (酯,醇) | 1000–1260 |
每个官能团可以吸收的波数有三个不同的区域:官能团区域、指纹区域和芳香区域。官能团区域在 4000 – 1500 cm-1 之间,大多数主要官能团的峰出现在该区域。指纹区域在 1500 – 900 cm-1 之间,许多弯曲振动出现在该区域。它不像官能团区域那么重要,但如果您不确定,它会为您提供一个区域来确认某个键的存在。最后一个区域在 900 – 600 cm-1 之间,提供有关芳香族化合物(如苯)存在的信息。
仅靠红外光谱不足以确定分子的结构。它必须与核磁共振光谱相结合才能产生用于结构识别的信息。
以下是某些官能团存在时的一些红外光谱。
醇的红外光谱
(3200 – 3400 之间的大宽峰)
羰基的红外光谱
(大约 1700 处的强峰)
核磁共振
[edit | edit source]核磁共振是**有机化学**和**生物化学**中最重要分析工具之一。与其他蛋白质测定技术相比,核磁共振具有优势,因为它可以分析溶液中大分子结构。其他技术(如 X 射线晶体学)需要大分子结晶。核磁共振在显示蛋白质结构的动态方面也非常有用,揭示了有关构象变化、折叠和与其他蛋白质相互作用的细节。核磁共振技术使用无线电频率范围内的低能辐射。辐射激发原子核,但只有某些特定同位素被激发;最常见的是 1H 和 13C。这些原子核可以被模拟为绕一个轴旋转,这种性质被称为核自旋。由于氢本质上是一个质子,它的自旋运动会产生磁场。就所有实际目的而言,可以想象氢与漂浮在空间中的磁铁是同义词。
当这些原子核被外部磁场激发时,它们可以具有两种取向之一,α 自旋态或 β 自旋态。这些核,1H 和 13C,可以被视为可以与磁场对齐(α)或与磁场相反(β)的微小原子磁铁。α 处于能量更有利的状态,而 β 处于高能状态。以恰好足以在 α 和 β 自旋态之间翻转的频率辐射样品,就会产生共振;样品吸收能量翻转到 β 自旋态。激发后,原子核恢复到原始状态,因此在共振时,原子核不断切换自旋状态。处于 β 状态的原子核在弛豫到 α 状态时释放能量。发生这种情况的共振频率与外部磁场的强度成正比。共振频率因原子核而异,这取决于其原子核和环境的特性。
氢 (1H) 核磁共振
[edit | edit source]共振频率在很大程度上取决于键的极性、连接原子的杂化和存在供电子或吸电子基团。当氢靠近吸电子基团(例如氯甲烷)时,氢被认为是去屏蔽的,因为键的极性将氢的电子云拉离原子核。相反的情况被称为屏蔽。这两种现象导致不同的氢具有不同的共振频率,因此具有不同的峰。当相应的原子核被屏蔽时,峰被称为处于高场或向右移动,而当原子核被去屏蔽时,峰被称为处于低场或向左移动。

从上面的 NMR 示例中,您可以看到屏蔽和去屏蔽如何影响峰值。“C” 基团氢位于最左侧,因为它被羰基去屏蔽。“B” 基团氢由于芳香性而被去屏蔽程度略低,而“A” 基团氢几乎没有被去屏蔽。
1H 核磁共振是使用最多的核磁共振之一,因为 1H 具有核自旋。它是带正电的。当它旋转时,它会产生磁场。当添加外部磁场时,质子可以具有 *a* 或 *B* 自旋。这两种状态之间的能量差产生共振。不同的原子具有不同的施加磁场强度。(CH3)4Si 用作标准。原子频率与 (CH3)4Si 频率之间的距离称为化学位移。
化学位移 = (峰与 (CH3)4Si 之间的距离,以赫兹为单位) / (光谱仪频率,以兆赫为单位)ppm
以下是一些常用化学位移的示例
伯烷基:0.8-1.0 ppm
仲烷基:1.2-1.4 ppm
叔烷基:1.4-1.7 ppm
末端烯烃:4.6-5.0ppm
内烯烃:5.2-5.7ppm
炔烃:1.7-3.1ppm
醇:0.5-5.0 ppm
芳香:6.0-9.5ppm
需要注意的是,醇的 OH 官能团、硫醇的 SH 官能团和胺的 NH2 基团的核磁共振光谱具有典型的宽峰。
处于不同化学环境中的氢原子(意味着它们连接了不同的原子,因此具有不同的键强度和键长,从而改变了电子在周围的“聚集”方式)会产生不同的化学位移。电子贫乏的环境被称为去屏蔽,并产生低场吸收(在光谱中更靠左)。相反,电子富集的环境被称为屏蔽,并导致高场峰(更靠右)。等效氢原子会产生相同的信号。如果化合物具有相同的连接性和键强度/键长,则它们具有相同的环境。例如,苯分子有 6 个不同的氢原子,但它们都处于相同的环境中。
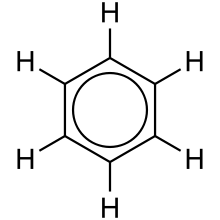
了解如何区分氢原子的等效性对于解读 1H NMR 非常重要。这可能很容易识别,例如感兴趣的原子核(此处为氢)周围原子的电负性,但变化可能更为细微,例如分子中的对称性使某些氢原子等效。为此,将展示苯酚分子。

虽然羟基确实改变了氢原子的屏蔽程度,但只有三种不同的氢原子。直接连接到 OH 基团的氢原子在连接性方面相似,但在对称性方面也相似。对称轴使它们相似,因为自然界不知道左右。连接到同一碳原子的氢原子通常具有相同的位移,但并非所有情况下都是如此。如果无法评估对称性,则氢原子完全不同。除此之外,1H NMR 还提供另一个提示,帮助我们推断化合物的结构,即积分。通过比较峰下方的相对面积,可以确定氢原子的比例。我们可以通过观察积分来找到氢原子的相对数量。此外,通过观察分裂,我们可以找到相邻的氢原子。氢原子之间的相互作用会干扰它们的磁场,从而影响其峰的形状。一个尖锐的峰称为单峰;一对峰中的一个称为双峰;一组三个峰中的一个称为三重峰;一组四个峰中的一个称为四重峰等等。它遵循 **n + 1 规则**。例如,如果我们看到一个峰,则没有氢原子连接到与连接到氢原子的原子相邻的原子。如果我们看到一个双峰,则意味着连接到此氢原子或这些等效氢原子的碳原子的相邻原子连接了一个氢原子,因为氢原子影响了峰。
碳 (13C) NMR
[edit | edit source]碳与 1H NMR 有着相同的原理,但 12C 对 NMR 没有反应,因此含量较少的 13C 将在 NMR 光谱中显示出来。分子中存在的碳原子中只有大约 1% 是 13C,因此峰的强度不如 1H。这种缺乏丰度至关重要,因为现在碳原子不受相邻碳原子影响,因为两个 13C 原子相互相邻的可能性非常小。这实际上非常有用,因为如果 13C 含量更多,不仅 13C NMR 会受到干扰,而且 1H NMR 也将受到干扰,这将使 NMR 光谱复杂化。唯一改变峰的因素是相邻的氢原子。与 1H 相同的原理适用于单峰、双峰、三重峰等。

混合熔点
[edit | edit source]可以使用混合熔点法确定未知晶体的成分。混合熔点法涉及混合等量的未知晶体和另一种已知熔点的化合物。首先,确定未知晶体的熔点;然后,可以使用熔点最接近未知晶体的已知化合物进行混合熔点。等量未知物和已知物的混合物将用刮刀一起研磨,并插入毛细管中。然后,将混合物插入熔点测定仪中,以确定其熔点。在这种情况下,未知物充当已知化合物的杂质。杂质通常会降低已知晶体的熔点。当混合两种不同的晶体时,会观察到不同的熔点,因为混合两种不同的化合物会破坏晶体的晶格结构,从而影响其熔点等物理性质。一种化合物充当另一种化合物的杂质,降低其熔点。如果这种混合物的熔点与已知物的熔点相同,则该混合物由两种相同的化合物组成,这意味着未知物和已知物具有相同的成分,因为相同的化合物不能充当自身的杂质。
示例:如果确定未知化合物(可能不是纯化合物)的熔点为 110°C,现在选择熔点最接近未知物的已知化合物。在本例中,将选择芴,并与未知物进行混合熔点。已知化合物及其熔点(摄氏度)安息香 – 95 芴-114 9 芴酮-84 未知物+ 芴- 112°C
以防万一,使用另一种已知化合物(熔点与未知物最接近的第二种化合物)与未知物进行混合熔点,即安息香。快速混合熔点表明,两种化合物的混合物熔点根本不在 110s°C 范围内,这排除了安息香作为未知物的可能性。因此,本例中的未知化合物被确定为芴,因为混合物的熔点与未知物的熔点几乎相同。熔点对于确定化合物的纯度也至关重要。例如,如果已知化合物是纯的,则该已知化合物的熔点可作为测量纯度的标准。通过将这种纯化合物的熔点与相同成分的样品化合物的熔点进行比较,可以确定样品化合物的纯度。样品熔点越接近纯化合物的熔点,样品就越纯。这是因为样品越纯,杂质就越少。正如我们之前所讨论的那样,化合物中存在的杂质越多,其熔点就会降低。因此,具有最高熔点的相同化合物也是最纯的。
熔点测定使用熔点测定仪进行。将化合物装入一端封闭的熔点毛细管中。通常需要轻敲几下才能使化合物到达管子的底部。将管子装入熔点测定仪后,逐渐施加热量,化合物将开始熔化。实验者可以通过显微镜观察化合物来跟踪熔化的过程。熔点测定仪提供了一种简单快速的方法来确定样品的纯度和成分! [1]
参考文献
[edit | edit source]Mohrig, Jerry R. 有机化学技术。 2006 年,W.H. Freeman 和公司
有机化学实验室,化学 143A
Shore Vollhardt. 有机化学,结构与功能,第 5 版。W.H. Freeman 和公司。纽约。
Ternansky, Robert. “实验 4a-b” CHEM 143A 讲座。加州大学圣地亚哥分校,拉荷亚。2012 年 2 月 3 日。讲座。







