结构生物化学/有机化学/有机合成
有机合成是有机化学中研究从其他可用化合物合成化合物的部分。有许多不同的方法来制造物质,合成研究了这些方法。有四种非常基本的反应用法可以帮助了解合成包括什么:SN1(单分子亲核取代)、SN2(双分子亲核取代)、E1(单分子消除)和E2(双分子消除)。
顾名思义,SN2反应涉及用其他基团取代某些基团。进来的基团和离开的基团需要具有一定的特性才能使反应发生,例如,如果离开基团无法离开或是不想离开的基团,反应就不会发生。进来的基团被称为亲核试剂。亲核试剂具有可以捐赠给某些缺乏电子密度的原子的电子,这种原子被称为亲电试剂。在取代反应中,亲电试剂具有与离开基团相连的基团。为了被认为是好的亲核试剂,该基团需要具有大量的电子密度,通常带负电荷,并且不能平衡这些额外的电子。分子可以通过几种方式平衡其电子密度。三种方法是:共振、原子半径、感应效应。其中,共振是最重要的因素,尽管原子半径也起着重要作用。感应效应可能很重要,但它是一种平衡力,其效力会迅速减弱。共振是指分子在两种不同状态之间振荡的现象,通常通过双键的移动来实现。这使得电荷在分子中移动。这种电荷的移动是一种过于简化的观察方式。实际上,分子以所有不同共振形式的混合状态存在。这种混合状态实际上将电子密度扩散到整个分子中。


原子半径在稳定电荷方面起作用。例如,所有卤素都有-1的离子形式。电荷对所有卤素来说都是一样的。变化的是原子半径。较大的半径意味着电子密度可以更多地分散,从而更好地平衡电荷。

感应效应是电负性原子将电子密度拉向自己的能力,并能以这种方式稳定电荷。然而,这种力随着电负性原子离电荷越远而迅速减弱。
可以捐赠电子的分子被称为路易斯碱,事实上大多数亲核试剂都是碱性的,尽管好的碱不一定就是好的亲核试剂。能够承受负电荷的分子(通过上述方法)可能是一个好的离去基团。
在溴甲烷分子中,离去基团是溴基团,亲电试剂是碳。这个溴基团具有很强的吸电子性,并且由于它具有很大的原子半径,因此可以消散电荷,这种现象被称为极化率。典型的SN2反应涉及溴甲烷和NaOH
反应发生后,新产物的立体化学将与之前完全相反。例如,如果它是与溴反应的(R)-碘丙烷,它将变成(S)-溴丙烷。立体异构中心发生反转的原因是亲核试剂在Sn2反应中进行背面进攻。


提高反应速率的方法
1. 增加亲核试剂或底物的浓度将提高反应速率。这是因为这是一个双分子反应,其中速率=k[亲核试剂][底物]:速率取决于亲核试剂和底物的浓度。增加亲核试剂的浓度将提高速率,因为速率与亲核试剂的浓度和底物的浓度成正比。底物也是如此。
2. 使用好的离去基团。
3. 提高体系温度。
4. 任何不会对亲核试剂造成空间位阻的东西都会提高反应速率。
5. 使用极性非质子溶剂,这意味着溶剂不含酸性质子。
SN2反应中2的原因是离去基团和亲核试剂都在反应的速率方程中。这意味着溴甲烷和NaOH的浓度都会影响反应速率。这是因为反应一步完成,只有一个中间体,其中离去基团-亲电试剂键断裂,亲核试剂-亲电试剂键形成。在SN1反应中,有两步,两个中间体。第一步是形成碳正离子,其中离去基团离开,碳带上正电荷。第二步是形成亲核试剂-亲电试剂相互作用。在这两步中,第一步是最慢的,称为速率决定步骤。这意味着无论亲核试剂有多少,反应速率都不会改变,直到底物的浓度发生变化。第一步非常慢,因为形成碳正离子不是非常有利的。要做到这一点,唯一的方法是离去基团必须非常优秀,并且必须有一种方法来稳定碳正离子。第一个很简单,找到一个具有非常好的离去基团的分子。通过使碳正离子成为仲碳正离子或叔碳正离子,电荷得到了更好的稳定。这是通过共振或超共轭实现的。甲基中的电子与碳正离子相互作用,并使其得到一定程度的稳定。
亲核试剂可以从底物的α面或β面进攻碳正离子。因此,通常会看到外消旋混合物,或者在生成的化合物中R和S构型的50:50混合物。
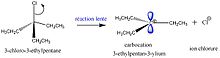
为了使慢速第一步发生,需要减慢快速第二步。要做到这一点,不要使用非常好的亲核试剂。可以不使用氢氧化物离子,而使用其共轭酸水。

提高Sn1反应速率的方法
1. 提高Sn1反应速率的另一种方法是使用极性质子溶剂。极性质子溶剂将提高反应速率,因为它将有助于稳定离去基团。它将稳定离去基团,因为它将溶剂化电荷。任何有助于稳定离去基团的东西都将使其更有可能离开,因为它将进入更低的能量状态。
2. 提高Sn1反应速率的另一种方法是添加盐。盐将通过离子相互作用来帮助稳定离去基团,并且由于离去基团将更加稳定,因此更有可能离开并形成碳正离子,速度快得多。
3. 提高Sn1反应速率的另一种方法是提高溶剂的极性。溶剂的极性将通过氢键来帮助稳定碳正离子。因此,如果要提高Sn1反应的反应速率,只需提高所用溶剂的极性。
4. 提高反应速率的另一种方法是提高体系温度。
5. 使用极性质子溶剂,这意味着溶剂具有酸性氢。
β支化对反应速率的影响
β支化意味着在与离去基团相连的碳原子相邻的碳原子上有一个碳链。对于SN2反应,β支化将由于空间位阻而减慢反应速度,因此烷基卤化物中β支化越少,SN2反应速度越快。根据SN1反应的实验结果,更多的β支化将由于空间位阻而减慢SN1反应速度,空间位阻会阻碍亲核试剂对碳正离子的进攻。
环状效应
实验表明溴环戊烷反应速度非常快,而溴环己烷需要一定时间才能进行反应,这表明五元环比六元环反应更快。造成这种情况的原因是环张力,指的是环上非相邻碳上的取代基之间的不利相互作用。环张力越小,SN1 和 SN2 反应速度越慢。五元环是这个规则的唯一例外,但一般来说,3、4、6 元环反应速度较慢,因为它们更稳定,能量更低。
芳香环效应
芳香环可以使伯卤代烷进行 SN1 反应,因为芳香环可以通过共振稳定碳正离子。芳香环的位置必须与离去基相隔一个碳原子,这样电子才能发生共振并稳定碳正离子。供电子基团会增加电子密度,从而“活化”环,使其更容易受到亲电进攻,从而提高反应速率,而吸电子基团会降低反应速率,因为它从芳香环中移除电子密度,如实验所示,甲氧基苄基氯(供电子基团)反应,而硝基(吸电子基团)则根本没有反应。
1. Vollhardt, K. Peter C., and Neil Eric Schore. Organic Chemistry: Structure and Function. New York: W.H. Freeman, 2011. Print.
