结构生物化学/有机化学/立体化学
立体化学:根据定义,立体化学是不同原子在空间中的排列方式。立体化学是 sp3 杂化的碳的 3D 表示。有许多不同类型的立体异构体。首先让我们讨论一些基本概念。
虽然大多数人习惯于将有机化学视为一堆图纸和结构,但这种“纸面化学”并不真正反映这些分子在现实生活中的行为。当然,这些分子实际上是三维形状,而不仅仅是二维图纸。立体化学旨在解释这些有机分子的空间排列的自然现象。

立体中心:分子中任何与 4 个不同原子相连的原子。也称为手性中心。手性分子很特别,因为它与其镜像图像不相同,或者换句话说,手性的唯一标准是物体与其镜像图像必须是非可叠合的。 [1]例如,甲烷 (CH4) 与其镜像图像相同;因此,该分子不是手性的。通常,具有“n”个手性中心的分子具有 2^n 个立体异构体。例如,具有 3 个立体中心的分子将产生具有 8 个立体异构体的分子。立体异构体是具有相同分子式和连通性,但空间原子排列不同的分子异构体。两种立体异构体的原子以相同的顺序连接在一起,但这两个分子没有相同的三维形状。楔形表示指向观察者的键,而虚线表示远离观察者的键。
被归类为非手性的分子要么不是 sp3 杂化的,要么是 sp3 杂化的,但具有两个或多个相同的取代基。这些分子不是手性的。非手性分子与其本身是可叠合的。

异构体是具有相同分子式,但结构彼此不同的分子。异构体主要分为两类:结构异构体和立体异构体。结构异构体,也称为结构异构体,是具有相同分子式,但连通性不同的分子。通常,结构异构体具有非常不同的物理和化学性质。立体异构体可以细分为两个子类别:对映异构体和非对映异构体。对映异构体是彼此镜像图像,且不可叠合的分子。这些分子具有相同的连通性,但在碳取代基的 3D 排列方面有所不同。通常,对映异构体具有非常相似的物理性质,但它们在化学性质上可能有所不同。非对映异构体不是镜像图像,但与对映异构体一样,具有相同的连通性,但在碳取代基的 3D 排列方面有所不同。
对映异构体是彼此镜像图像,且不可叠合的结构。不可叠合意味着无论你以何种方式旋转它,你都无法将它直接放在另一个与相同方向面对的顶部。你可以很容易地用你的手来证明这一点,因为你的手也是不可叠合的,因为你无法将你的手放在彼此的顶部,让你的拇指朝向相同的方向,而你的手掌朝向相同的方向。对映异构体具有相同的物理和化学性质。

对映异构体通常用 R 或 S 结构进行分类。要确定立体中心是标记为 R 还是 S,首先必须根据分子量对它的四个取代基进行排序。最高优先级取代基(等级 1)将是具有最大分子量的取代基原子;相反,最低优先级取代基(等级 4)将是具有最小分子量的取代基原子。因此,氢取代基总是被赋予最低优先级。一旦四个取代基按优先级排序,就可以遵循一系列规则来确定立体中心的 R 或 S 结构。 [1]
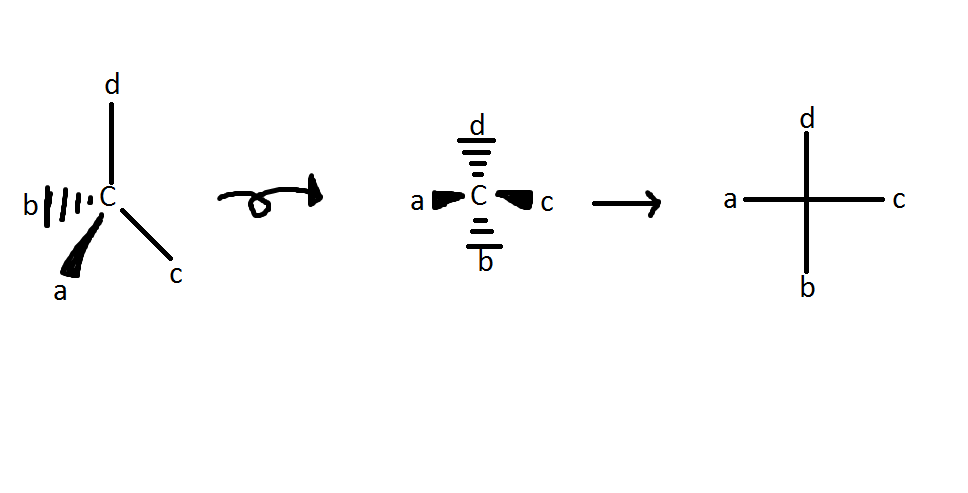
规则 1:最低优先级取代基总是被放置在尽可能远的地方,或者换句话说,被放置在纸张或板子中。
规则 2:一旦最低优先级取代基(通常是氢)被放置在“纸张中”,剩下的三个取代基(R 和 S)只有两种可能的排列方式。从最低优先级取代基键向下看碳原子,如果剩下的三个取代基按顺时针方向递增(1、2、3),则立体中心被归类为 R。如果三个取代基按逆时针方向递增,则立体中心被归类为 S。
规则 3:差别点规则。此规则有助于确定取代基的优先级,这些取代基在查看直接连接到立体中心的原子时具有相同的等级。一个简单的例子是甲基和乙基取代基之间的区别。沿着取代基超越初始碳原子,甲基连接到三个氢原子,而乙基的碳连接到两个氢原子和另一个碳原子。这是取代基的差别点。由于乙基中的碳原子比甲基中的第 3 个氢原子具有更高的优先级,因此乙基取代基的优先级高于甲基取代基。 [1]
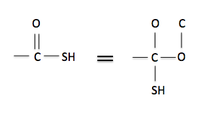
规则 4:双键和三键可以被视为单键,但额外的键被添加到多键的每一端作为单键。这可以在右边的图上看到。碳连接到硫醇基团,并与氧形成双键。这个双键可以被视为碳连接到两个单键氧原子,而第二个氧连接到碳原子(代表与初始碳的双键)。
对映异构体具有旋光性,这意味着它们能够旋转平面偏振光。右旋 (+) 分子使平面偏振光按顺时针方向旋转,而左旋 (-) 分子使平面偏振光按逆时针方向旋转。对映异构体在每个化合物旋转平面偏振光的方向上有所不同。

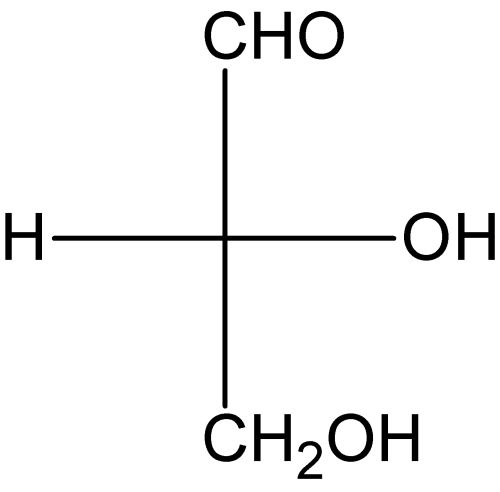
从图中可以看出,在左侧,甲基指向我们,而羟基指向后。在右侧的分子上,这个顺序颠倒了。这是对映异构体的典型例子。
人们可能认为你可以简单地旋转分子,它们就会完全相同,但事实并非如此。如果你旋转上面的分子,羟基和甲基会互相叠合,但是,氟和氢现在将位于相对侧。这就是不可叠合的含义
通常,人们会对内消旋化合物感到困惑。例如,假设有两个分子:一个分子以其立体中心的 1R,2S 结构为特征(手性中心),另一个分子以其各自立体中心的 1S,2R 结构为特征。人们可能想知道为什么这些分子不是彼此的对映异构体——毕竟,它们在所有各自的立体中心处确实具有相反的结构。然而,这些分子不是对映异构体,因为它们是内消旋化合物。在这种情况下,每个化合物都有一条对称线将它的两个立体中心分开。由于每个分子都有对称平面,因此每个化合物都被认为是非手性的(不是手性的)。
如果两种分子由相同数量的每个对映异构体组成,即左旋对映异构体和右旋对映异构体的 50:50 比例,则它们被认为是外消旋的。
外消旋分子没有显示出旋转平面偏振光。单独地,每个对映异构体都会旋转平面偏振光,但它们会以相等且相反的方向旋转,从而导致净旋转为 0。
光学活性与化合物中两种对映异构体的比例成正比。当化合物中两种对映异构体的比例相等时,该样品被认为是光学非活性或外消旋体。如果只存在一种对映异构体,则该样品被认为是光学纯的。为了描述介于这两种极端之间的混合物,可以使用对映异构体过量 (ee) 关系。这用于当混合物中一种对映异构体比另一种对映异构体过量时。[1] 对映异构体过量方程为
对映异构体过量 (ee) = 主要对映异构体的百分比 - 次要对映异构体的百分比
对映异构体过量方程告诉我们,在一个外消旋溶液中,一种对映异构体比外消旋溶液多多少(因为在外消旋体中,对映异构体的比例是 1:1)。对映异构体过量也称为光学纯度,可以通过以下关系式求得
对映异构体过量 (ee) = 光学纯度 = ([a]混合物/[a]纯对映异构体) X 100%
示例
从文物中获得的 (+)-丙氨酸溶液的值为 [a]混合物 = 3.7;[a]纯对映异构体 = 8.5。求光学纯度和样品的实际对映异构体组成。[1]
解答
对映异构体过量 = 光学纯度 = (3.7/8.5) X 100% = 43.5% 因此,样品的 56.5% 是外消旋体,样品的 43.5% 是纯 (+) 异构体。因此,可以得出结论,所检验的文物中 (+) 和 (-) 丙氨酸的实际组成分别为 71.75% 和 28.25%。
光学活性
[edit | edit source]如果将手性分子的两种对映异构体以纯形式分离到两个不同的容器中,则仅凭它们的物理性质,如沸点、熔点和密度,很难区分这两种对映异构体。因为只有某些药物的某些对映异构体有效,而其他对映异构体对人体无效甚至有害,所以能够区分对映异构体非常重要。
幸运的是,手性分子具有一个独特的性质,当一束称为平面偏振光的特殊光通过包含对映异构体的样品时,手性分子会以特定方向旋转。手性分子与平面偏振光之间这种独特的反应称为光学活性,因此对映异构体通常被称为光学异构体。从面对光源的观察者的角度来看,特定手性分子的旋转方向可以是顺时针方向,即右旋性(“dexter”在拉丁语中意为“右”),或者逆时针方向,即左旋性(“laevus”在拉丁语中意为“左”)[2]。顺时针旋转的分子被称为 (+) 对映异构体,而逆时针旋转的分子被称为 (-) 对映异构体 [2]。任何特定手性分子的旋转方向始终相同,该手性分子的对映异构体将具有相反的旋转方向。
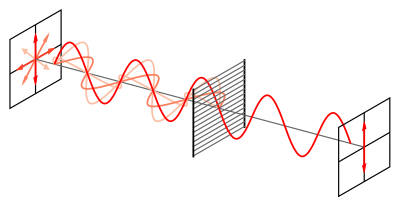
平面偏振光是由一束普通光通过一种称为偏振器的特殊材料产生的。偏振器充当通过它的光波的过滤器,过滤掉除一种光波(平面偏振光波)以外的所有光波 [2]。光被过滤成仅平面偏振光后,光波穿过手性分子。光波的电场与手性分子周围的电子相互作用,导致分子以特定方向旋转;这种旋转称为光学旋转 [2]。如果样品中存在光学旋转,则该样品被称为光学活性。为了确定样品是否具有光学活性,必须使用旋光仪测量光学旋转。
通常,产生手性分子的反应不是立体专一的,这可能导致产物具有 1:1 的对映异构体混合物。这种反应混合物被称为外消旋混合物,因为当一束平面偏振光通过该样品时,一半的手性分子会顺时针旋转,而另一半会逆时针旋转。这会导致样品没有净光学活性。然而,当对映异构体的比例不是 1:1 时,则会存在光学活性。制药公司的主要目标之一是进行产生光学纯产物的反应,因为这可以节省他们在光学不纯样品纯化过程中花费的大量时间,更不用说生产过程中使用的试剂的成本了。
氨基酸的立体化学
[edit | edit source]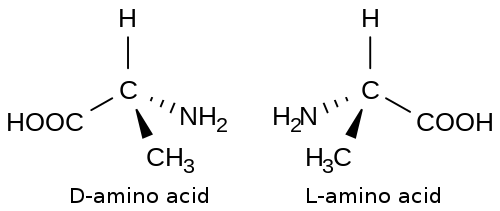
氨基酸是蛋白质的组成部分。氨基酸的一般结构具有一个 sp3 杂化的碳原子,连接到另外四个取代基。连接到所有氨基酸碳原子的四个取代基中的三个是氨基、羧基和氢原子。最后一个取代基通常用 R 表示,如果氨基酸没有指定。R 可以代表二十种不同氨基酸所具有的二十种不同的侧链。
氨基酸的立体化学用 L,D 体系表示。L,D 体系本质上与绝对构型的 R,S 体系相同,区别在于 L,D 体系用于氨基酸。对于 L,D 体系,L 等于 S 绝对构型,D 等于 R 绝对构型。
氨基酸主要以 L 绝对构型存在。目前没有关于 L 异构体在 D 异构体上占主导地位的结论性证据。许多人推测,L 异构体成为占主导地位的氨基酸构型是由于偶然而非任何物理或化学性质。已经进行了一些实验试图阐明 L 异构体占主导地位的原因。在这些实验中,用仅含 D 绝对构型的氨基酸人工合成蛋白质。结论是,仅由 D 氨基酸组成的蛋白质与由 L 氨基酸组成的蛋白质一样具有活性,唯一的区别是,由 D 氨基酸组成的蛋白质的反应是与由 L 氨基酸组成的蛋白质相反的反应。
非对映异构体
[edit | edit source]非对映异构体是任何不是对映异构体的立体异构体。因此,非对映异构体不是彼此的镜像。由于非对映异构体是彼此不是镜像的立体异构体,因此它们可以通过不同的物理和化学性质来区分。因此,可以通过标准的实验室技术分离非对映异构体。当分子的立体异构体在其至少一个立体中心(但不是全部,因为它们将是对映异构体)具有不同的构型时,就会出现非对映异构体。每个立体中心具有两种构型,因此立体异构体的数量增加了两倍。顺反异构是一种非对映异构体形式(顺式 - 两个取代基指向相同方向;反式 - 两个取代基指向相反方向)。
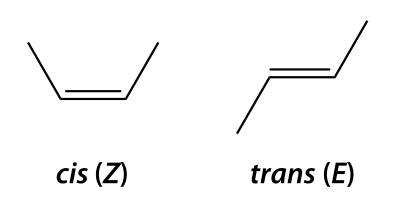

虽然对映异构体具有相同的化学性质,但非对映异构体则不同。
下面分子中含有 3 个立体中心。第一个和第三个碳原子上的原子已被交换。这是一个非对映异构体的例子。如果第二个碳原子也被交换,那么这两个分子将是对映异构体。
烯烃的立体化学
[edit | edit source]当使用 E,Z 体系命名烯烃时,顺式和反式前缀基本上不存在。E,Z 体系为碳取代基设置优先级的方式与 R,S 体系相同,区别在于双键对优先级没有影响,只有与碳单键连接的两个取代基。E 异构体(E 来自德语单词“entgegen”,意思是“相反”)是指双键上每个碳的最高优先级取代基彼此相反 [1]。Z 异构体(Z 来自德语单词“zusammen”,意思是“一起”)是指双键上每个碳的最高优先级取代基在彼此的同一侧 [2]。
差向异构体
[edit | edit source]差向异构体是只在一个立体中心上不同的非对映异构体。
下面分子中含有 3 个立体中心。原子只在第三个碳原子(右侧)的立体中心上被交换了。这是一个差向异构体的例子。
异头物
[edit | edit source]"异头物是在环闭合时形成的新不对称碳原子上不同的异构体"。[2] α-D-葡萄糖和 β-D-葡萄糖(如下所示)就是这种情况。


费歇尔投影式
[edit | edit source]在费歇尔投影式中,连接取代基到中心碳的键用水平线和垂直线表示。类似于虚线-楔形线结构,水平线表示指向观察者的键,而垂直线表示背离观察者的键。这是一种简化的方法,用于在二维空间中显示四面体碳原子及其取代基。将虚线-楔形线结构转换为费歇尔投影式是一个简单的过程。下面给出了一个示例。
区分对映异构体和非对映异构体的一种简单方法是观察比较的分子,假设它们都是立体异构体,然后观察每个手性中心。如果每个手性中心的碳取代基都被交换了一次,那么这些分子是对映异构体。如果并非所有手性中心的碳取代基都被交换了一次,那么这些分子是非对映异构体。在这种情况下,碳取代基的交换意味着,例如,同一个碳上的虚线 OH 取代基和楔形 H 取代基被交换为楔形 OH 取代基和虚线 H 取代基,而其他两个碳取代基保持在相同的位置。根据这种逻辑,如果手性中心的碳取代基被交换了两次,那么这些分子是对映异构体,而不是非对映异构体。
如今,大多数手性药物以外消旋混合物的形式出售。在两种对映异构体中,其中一种是无活性的。根据 Vollhardt[3],另一个对映异构体会通过成为生物受体位点的阻断剂来阻止另一个对映异构体的活性。因此,FDA 开始生产药物的单个对映异构体。因此,他们开始测试纯对映异构体,以帮助提高药物的性能,并可能有助于延长药物的专利。此外,他们应用了“手性转换”方法来开发不同的对映选择性合成方法。“手性转换”是指在手性催化剂催化的反应中,将非手性反应物转变为手性产物的过程。Vollhardt 指出,此类方法已应用于生产抗关节炎药物、止痛药萘普生和降压药心得安。
1. Schore, Neil E. (2011). 有机化学结构与功能 第 6 版. W. H. Freeman.
2. Berg, Jeremy Mark, John L. Tymoczko, 和 Lubert Stryer. 生物化学. 第 6 版. 纽约:W H Freeman & Co, 2012.
3. Schore, Neil E. (2007). 有机化学结构与功能 第 5 版. W. H. Freeman.
3. Berg, Jeremy M. (2002). 生物化学 第 5 版. W. H. Freeman.
4. Vollhardt, Peter 和 Schore, Neil. (2009). 有机化学 第 9 版. W.H. Freeman and Company. ISBN 978-1-4292-0494-1.