结构生物化学/蛋白质
蛋白质是一种功能性生物分子,由一个或多个多肽组成,这些多肽折叠/盘绕成特定的结构 [1]。蛋白质是重要的生物大分子,充当结构元素、运输通道、信号受体和传递者以及酶。蛋白质是线性的聚合物,由称为氨基酸的单体单元构成。有 20 种不同的氨基酸,它们通过羧基和氨基之间的肽键连接,形成一条称为多肽的线性链。每种蛋白质都有不同的侧链或“R”基团。蛋白质具有许多不同的活性官能团附着在其上,以帮助定义其性质和功能。蛋白质涵盖了广泛的功能,从非常刚性的结构元件到细胞之间的信息传递。每个人体内都有数十万种不同的蛋白质。蛋白质根据功能基团之间的分子内键合或分子间键合(仅四级结构)折叠成二级、三级和四级结构,并且可以根据氨基酸序列获得各种三维形状。所有蛋白质都具有初级、二级和三级结构,但四级结构仅在蛋白质由两个或多个多肽链组成时出现 [1]。蛋白质的折叠也受到链的不同部分之间形成许多键的驱动和增强。这些键的形成取决于氨基酸序列。对它们结构的研究很重要,因为蛋白质对人体中的所有活动至关重要,并且是生物材料的关键成分。一级结构是指氨基酸通过肽键连接在一起形成多肽链。二级结构是指多肽链折叠成规则的结构,如β折叠、α螺旋、转角或环。功能性蛋白质远不止多肽,它是一个或多个已精确折叠成具有非常特定、独特形状的分子,这对其功能至关重要 [1]。
蛋白质通常以 3D 结构显示,并分为四种不同的特征和级别

一级: 蛋白质的一级结构是指蛋白质结构的级别,它指的是氨基酸的特定序列 [1]。当两个氨基酸处于这样的位置,即每个氨基酸的羧基彼此相邻时,它们可以通过进行脱水反应来结合,从而导致肽键的形成 [1]。多肽(蛋白质)中的氨基酸通过肽键连接,肽键从具有游离氨基的 N 端开始,到具有游离羧基的 C 端结束。肽键是平面的,由于部分双键特征,无法自由旋转。虽然肽键的旋转受限,但 (N-C) 键和 (C-C) 键有两个自由旋转,称为扭转角,更具体地说,称为 φ 角和 ψ 角。由于空间位阻,这两个键的旋转自由度也受到限制。基因携带制造具有确定氨基酸序列的多肽的信息。一个平均多肽大约有 300 个氨基酸长,有些基因编码的肽链有几千个氨基酸长。重要的是要知道蛋白质的一级结构,因为一级结构编码在其生物学功能中具有功能重要性的基序;结构和功能在所有级别的生物组织中都是相关的 [1]。
二级: 多肽的氨基酸序列,以及化学和物理定律,导致多肽折叠成更紧凑的结构。氨基酸可以在蛋白质内的键周围旋转。这就是蛋白质灵活且可以折叠成各种形状的原因。折叠可以是不规则的,或者某些区域可以具有重复的折叠模式。由于多肽主链重复片段之间形成的氢键导致的螺旋和折叠称为二级结构 [1]。虽然单个氢键很弱,但由于它们在链的大部分区域重复多次,因此它们能够支撑蛋白质该部分的特定形状 [1]。蛋白质的二级结构是由鲍林和科里提出的。它的结构是由位于彼此短距离内的氨基酸形成的。由于肽键的平面性质,只存在某些类型的二级结构。三个重要的二级结构是 α-螺旋、β-折叠和β-转角。此外,β折叠可以是平行的、反平行的或混合的。反平行β折叠更稳定,因为氢键成 90 度角。α-螺旋是一种螺旋结构,由链内氢键稳定。
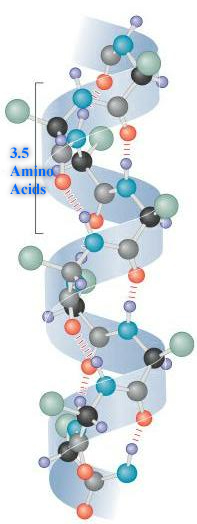
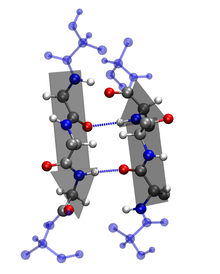
二级结构的特征:
1. α-螺旋: 在 α-螺旋中,多肽主链形成重复的螺旋结构,由羰基氧和胺氢之间的氢键稳定。这些氢键以每四个氨基酸一个氢键的规律间隔出现,导致多肽主链形成螺旋 [1]。最常见的螺旋结构是右手螺旋,其氢键平行于其轴线。氢键在四个氨基酸残基外的羰基氧和胺氢基团之间形成。每个氨基酸沿着其轴线将螺旋前进 1.5 Å。螺旋的每个周转由 3.6 个氨基酸组成;因此螺旋的螺距为 5.4 Å。螺旋平均包含十个氨基酸残基,其侧链朝向螺旋外部。不同的氨基酸具有形成 x-螺旋的不同倾向,但脯氨酸是螺旋破坏者,因为脯氨酸没有游离的氨基。更喜欢在蛋白质中采用螺旋构象的氨基酸包括蛋氨酸、丙氨酸、亮氨酸、谷氨酸和赖氨酸(malek)。
2. β-折叠: ß-折叠通过肽链之间的氢键稳定。在 β-折叠中,多肽主链的区域彼此平行排列,并通过氢键连接 [1]。氢键在多肽中相邻链的氨基酸的羰基氧和胺氢之间形成,这意味着氢键是链间的。β-折叠区域比 α-螺旋更伸展,相邻氨基酸之间的距离为 3.5 Å。β-链中的氢键可以平行、反平行或混合出现。β-平行构型中的氨基酸残基以相同的方向运行。褶皱片构成了许多球状蛋白质的核心,并且也是一些纤维状蛋白质(如蜘蛛网)中的主要结构 [1]。大的芳香族化合物(如:色氨酸、酪氨酸和苯丙氨酸)和β-支链氨基酸(如:异亮氨酸、缬氨酸和苏氨酸)更喜欢采用β-链构象。这种方向在能量上不利,因为其氢键倾斜且非垂直。色氨酸、酪氨酸和苯丙氨酸是疏水性的,而其他氨基酸是亲水性的。
3. β-转角: 多肽链可以通过进行反转弯和环来改变方向。连接两个反平行 β-链的环区域称为反转弯或 β-转角。这些环区域的长度和形状不规则,通常位于蛋白质表面。转角通过羰基氧和胺氢的主链之间的氢键稳定。在许多反转弯中,残基的 CO 基团与残基 i + 3 的 NH 基团键合。这种相互作用稳定了多肽链方向的突然变化。与α-螺旋和ß-链不同,环没有规律的周期性结构。然而,它们通常是刚性的和明确定义的。由于环位于蛋白质的表面,因此它们能够参与蛋白质和其他分子之间的相互作用。Ramachandran 图是一个显示蛋白质可以找到的可用扭转角的图。然而,在图中,如果到处都有很多点,那就意味着存在一个环。
三级: 由于一级结构,二级结构开始建立,多肽折叠并在自身上重新折叠,以形成称为蛋白质三级结构的复杂三维形状。三级结构是多肽的整体形状。[1] 三级结构是由各种氨基酸的侧链(R 基团)之间的相互作用产生的 [1]。这种三维结构是由于多肽链中侧基之间的分子内相互作用而产生的。其结构域通常包含 300-400 个氨基酸,当从其亲本蛋白质中分离出来时,它会采用稳定的三级结构。当多肽折叠成其功能形状时,具有疏水侧链的氨基酸往往会聚集在蛋白质的核心,以使其与水隔离 [2]。称为二硫键的共价键也会影响蛋白质的形状 [1]。二硫键是在蛋白质折叠方式使两个包含其侧链上巯基的氨基酸彼此靠近时形成的 [1]。对于某些蛋白质(如核糖核酸酶)来说,三级结构是功能性蛋白质的最终结构。其他蛋白质由两个或多个多肽组成,并采用四级结构。
四级结构:虽然所有蛋白质都包含一级、二级和三级结构,但四级结构是为由两个或多个多肽链组成的蛋白质保留的 [1]。具有四级结构的蛋白质包含不止一个多肽,并且每个多肽都采用三级结构,然后通过分子间相互作用组装在一起。蛋白质的四级结构是这些多肽亚基添加后的整体结构 [1]。单个多肽被称为蛋白质亚基,这意味着不同的多肽分别折叠。亚基可以是相同的多肽,也可以是不同的多肽。当蛋白质由多个多肽链组成时,它们被称为具有四级结构,也称为多聚体蛋白质,这意味着由许多部分组成的蛋白质。四级结构也可以定义为当多个蛋白质聚在一起形成二聚体、三聚体、四聚体等时 [2]。血红蛋白是四级结构的一个例子,它由两个α亚基和两个β亚基组成。

球状蛋白和纤维状蛋白
[edit | edit source]纤维状蛋白:纤维状蛋白也称为硬蛋白,是长长的蛋白质链,形状像棒状线。与球状蛋白不同,它们不容易变性,并且包含许多重复的二级结构。它们主要是结构蛋白,负责生物体的支撑和保护,例如形成结缔组织、肌肉纤维、骨骼和肌腱。纤维状蛋白的两个例子是
1. α-角蛋白:α-角蛋白(头发、蹄子、角、指甲等中必不可少)是一种螺旋状蛋白,由两个相互缠绕的α-螺旋组成。螺旋状结构存在于其他结构蛋白中,例如骨骼肌的肌球蛋白;它具有与每个转弯 3.5 个氨基酸相对应的七肽重复。这些蛋白质螺旋中 a、d、a' 和 d' 位置的残基通常是疏水的。螺旋状结构中的两条链通过疏水相互作用以及离子相互作用和二硫键连接在一起。
2. 胶原蛋白:胶原蛋白(肌腱、软骨、血管壁)是人体中最丰富的蛋白质。胶原蛋白是一种三螺旋结构,与α-螺旋不同,它有 3.3 个氨基酸和每圈 10 Å。胶原蛋白通过氢键稳定,氢键形成于位于相邻链上的氨基酸的羰基氧和胺氢之间,并且垂直于纤维轴。它富含脯氨酸,并含有羟脯氨酸和羟赖氨酸。然而,由于脯氨酸含量丰富,没有链内氢键,脯氨酸和赖氨酸的羟基化需要维生素 C。维生素 C 缺乏会导致坏血病。胶原蛋白中三分之一的氨基酸是甘氨酸,因为空间拥挤;只有甘氨酸存在于胶原蛋白分子的中心。胶原蛋白分子可以通过共价键交联形成更大的纤维和片层。
球状蛋白:球状蛋白折叠起来以埋藏疏水侧链。所有球状蛋白都有一个内部,疏水核心排列在其中。它有一个朝外的部分,亲水基团朝向该部分。不带电荷的极性氨基酸残基通常位于蛋白质表面,但它也可能出现在内部。在后一种情况下,它会与其他基团形成氢键,即 ser、thr、tyr 都是极性的、不带电荷的。
影响蛋白质结构的因素
[edit | edit source]几个因素决定了多肽如何采用它们的二级、三级和四级结构。多肽的氨基酸序列是区分一种蛋白质与另一种蛋白质结构的决定性特征。随着多肽在细胞中合成,它们折叠成二级和三级结构,对于大多数蛋白质,它们组装成四级结构。如前所述,化学和物理定律以及氨基酸序列共同支配着这个过程。五个因素对于 蛋白质折叠 和稳定性至关重要
1. 氢键:氢键形成于氢键供体和氢键受体之间。对于氨基酸,氢键将在胺基的骨架和羰基的氧之间发生。
2. 离子键:静电相互作用发生在两个带相反电荷的分子之间。离子相互作用在水中比在真空中弱,这是由于蛋白质结构中相反电荷之间面对的介电常数不同。
3. 疏水效应:疏水相互作用源于非极性分子最小化它们与水的相互作用的趋势。当非极性分子与水相互作用时,这些分子倾向于聚集在一起形成一个胶束。
4. 范德华力:范德华力存在于非极性分子之间,在很近的距离。在三种范德华相互作用中,永久偶极之间的相互作用最强,偶极-诱导偶极相互作用比永久偶极弱,而伦敦色散力最弱。虽然单个原子之间的范德华力很弱,但许多原子在大型大分子中相互作用所产生的范德华力的总和可能很大。范德华相互作用的强度随原子之间距离的变化而变化,在范德华接触距离时最大。
5. 二硫键:二硫键可以通过氧化在两个半胱氨酸之间形成。这些也是蛋白质三级结构中最强的共价键。
蛋白质变性
[edit | edit source]蛋白质变性:是指三级结构的天然构象丧失。变性蛋白质经历内部三级或二级结构的破坏或破坏。然而,变性不会破坏相邻氨基酸之间的肽键,因此不会影响蛋白质的一级结构。然而,变性会干扰蛋白质中正常的α-螺旋和β-折叠,最终扭曲其 3D 形状。
变性会导致靠近的氨基酸之间的氢键断裂,从而干扰蛋白质的二级和三级结构。在三级结构中,"侧链"之间有四种类型的键合相互作用,包括:氢键、离子桥、二硫键和疏水分子间相互作用。换句话说,有几种不同的条件可以使蛋白质的构象变性。
使蛋白质变性的条件:
1. 极端 pH (pH < 4 或 pH > 9) : 改变 H-键
2. 热 (temp >70oC): 热效应,破坏非共价键的弱力
3. 去垢剂或有机溶剂 : 破坏疏水相互作用
4. 变性剂 (高浓度) : 例如,尿素和盐酸胍
特定蛋白质的激活需要定位在其特定位置
[edit | edit source]随着科学家开始发现化学的更多方面,他们实际上发现了细胞化学/生物学中的复杂性程度。虽然科学家发现蛋白质在体内起着至关重要的作用,但他们也发现蛋白质在细胞中的特定部位自行组装,只有在需要时才会被激活。使用 GFP 标记蛋白(荧光)在活细胞中,观察到蛋白质的位置和重新定位响应特定信号的变化。当细胞外信号分子与受体蛋白结合时,它会将不同的蛋白质拉入质膜的内部区域,以创建传递信号的蛋白质装置。

人类有 10 种 PKC 酶,它们在调节和功能方面都不同。当 PKC 被激活时,它将从细胞质移动到各种细胞内位置,最终与其他蛋白质形成特定的复合物,从而使它们能够磷酸化不同的蛋白质底物。各种连接酶表达这种行为,例如 SCF 泛素连接酶。这些机制涉及蛋白质磷酸化和支架蛋白之间的协作,这些支架蛋白将特定的激活、抑制、衔接子和底物蛋白连接到细胞的特定部分。

这种现象被称为诱导邻近性,它描述了为什么具有相同反应位点的酶的微小不同形式可以具有不同的功能的原因。这可以通过多种方式共价修饰蛋白质的位置来完成。这些改变在蛋白质上构建结合位点,以便它可以与支架蛋白结合,使它们聚集在一起,以便不同的反应可以在细胞的特定位置发生。因此,支架允许细胞在不需要膜的情况下对反应进行分组。
人们过去认为支架蛋白将蛋白质固定在彼此相关的特定位置,但实际上,多肽链的无结构区域连接着相互作用的蛋白质。这使得蛋白质能够以随机方向频繁地相互碰撞,其中一些碰撞会导致成功的反应。蛋白质的束缚允许更快的反应速度。因此,支架蛋白为控制细胞化学提供了灵活的方法。

DEAD 盒蛋白由 RNA 解旋酶组成,它们参与 RNA 代谢过程,并且在细菌和病毒到人类中发现的九个结构域中是保守的。它们长 350 个氨基酸。DEAD 盒蛋白参与前 mRNA 加工、剪接体形成和核糖核蛋白 (RNP) 复合物的重新排列。DEAD 盒蛋白是前 mRNA 剪接和体内剪接过程所必需的。在 pre-mRNA 加工过程中,DEAD 盒蛋白解旋以提供能量来重新排列前 mRNA 剪接所需的五个 snRNP(U1、U2、U4、U5 和 U6)。在体内剪接中,需要三种 DEAD 盒蛋白,Sub2、Prp28 和 Prp5。Prp5 帮助重新排列 U2 的构象,这使得 U2 序列能够结合到分支点序列。Prp28 有助于识别 5' 剪接位点。
第一个 DEAD 盒蛋白,ElF4A 翻译起始因子,依赖于 RNA ATPase 活性。这种蛋白有助于解开二级结构,从而阻止扫描。
细胞的分子生物学 第 5 版 阿尔伯茨
生物化学 第 6 版 伯格、蒂姆科和斯特里尔
坎贝尔生物学 第 9 版 尼尔·坎贝尔和简·里斯 2010
