结构生物化学/蛋白质/核磁共振波谱
NMM 光谱法独一无二,它能够揭示溶液中大分子(只要能获得高浓度溶液)的原子结构。这种技术依赖于某些原子核本身具有磁性。原子核的化学位移取决于它们局部的环境。此外,相邻原子核的自旋以提供确定性结构信息的方式相互作用。这些信息可用于确定蛋白质的完整三维结构。
核磁共振波谱(NMR)是一种分析技术,它利用了某些原子核具有称为自旋(I)的性质这一事实。NMR 波谱法之所以成为可能,是因为塞曼效应,塞曼效应最早是在 19 世纪 90 年代发现的。通过首先制备同位素标记的样品,可以通过 NMR 确定蛋白质的结构。在磁体中,样品中原子中的“天然磁铁”与 NMR 磁体的磁场对齐。然后,样品暴露于一系列无线电波脉冲以破坏原子的磁平衡。可以观察这些原子核的反应以评估它们的化学性质,特别是它们的化学位移特性。可以进行一组实验来细化可能的结构,并将实验的平均值作为最终结构呈现。它与 X 射线晶体学相比具有优势,因为蛋白质样品可以处于溶液状态而不是结晶形式,并且可以确定样品蛋白质的其他性质,例如灵活性相互作用,而 X 射线晶体学只能揭示蛋白质的结构。
当原子置于磁场中时,原子能级发生分裂。后来发现这种效应是由于核自旋造成的。1924 年,沃尔夫冈·泡利首次提出了 NMR 的理论基础,他得出结论,一些原子核应该具有核自旋,而这些原子核在置于磁场中时会分裂成简并能级。这些原子核本身具有磁矩,称为自旋。具有自旋的原子核被称为 NMR 活性。表 1 中显示了一些 NMR 活性原子核,其中斜体字的原子核是生物分子中常见的原子核。

分别在 1946 年,斯坦福大学的博尔奇和哈佛大学的珀塞尔将塞曼效应转化为第一个 NMR 谱图。1949 年,斯坦福大学的普罗克特和于首次测量了化学位移和自旋耦合。最初,商用 NMR 光谱仪是连续波型的,只能检测最灵敏的原子核,即 1H 和 19F。如果原子核自旋 I 不为零,则 NMR “活性”原子核是活性的。
确定原子核自旋
质量数为偶数且中子数为偶数,I=0,因此没有自旋
质量数为偶数且中子数为奇数,I=整数,因此具有自旋
质量数为奇数且中子数为偶数或奇数,I=半整数,因此具有自旋
可以使用以下类比来直观地理解自旋的原因。旋转的带电粒子(例如氢原子核,也称为质子)将在旋转方向上产生一个垂直的磁场,类似于条形磁体的磁场,如图 1 所示。

在没有外部磁场(B¬0)的情况下,这些活性原子核随机地定向,但在存在外部磁场(B¬0)的情况下,这些原子核会与场对齐,要么顺磁场方向,要么逆磁场方向,如图 2 所示。

原子核在不同能量状态之间分散。外部磁场(B¬0)的存在会导致不同能级。对于自旋 1/2 原子核,两种方向是可能的,较高能量方向是“β 自旋态”,较低能量方向是“α 自旋态”。这在以下方程中很明显,其中 E=能量,h=普朗克常数,ν=频率,γ=旋磁比(取决于原子核),B0=外部磁场
ΔE= h ν = γ B0
要从图形上看到这一点,请参见图 3。

这些诱导的能级差使得 NMR 的使用成为可能。在平衡时,原子核将占据两个能级,低能级和高能级。然而,根据麦克斯韦-玻尔兹曼分布,低能级将被更多数量的原子核占据。低能级和高能级之间原子核数量的这种差异是 NMR 利用的。引起自旋翻转,即从低能态到高能态跃迁所需的能量对应于电磁频谱的无线电频率范围。ΔE= h ν 当电磁辐射的频率恰好与能量变化 ΔE 相匹配时,原子核才会翻转自旋,吸收能量。这被称为共振点。原子核的共振频率将根据其局部的电子环境而不同。这可以在“质子 (1H) NMR 谱图的手工示例”中看到。所有正在观察的原子核都被无线电波照射到较高能量状态,然后被允许衰变回较低能量状态。这种衰变是观察到的。当原子核回落到较低能量状态时,会收集自由感应衰减信号,图 4 描绘了一个通用的 FID。

然后将该 FID 进行傅里叶变换,以从时域转换为频域,如图 5 所示。

磁场强度的变化将改变原子核的共振频率。因此,为了比较不同磁场强度仪器的谱图,必须从频率转换为百万分率(ppm)。这可以使用图 6 中所示的方程式完成。

随着 20 世纪 70 年代傅里叶变换仪器的出现,可以采集自然丰度不高的原子核的谱图,例如 13C,它在自然界中的丰度仅为 1.1%。这需要采集多个谱图并将它们加在一起才能获得更高的灵敏度。由于信号幅度随采集次数线性增加,而噪声幅度随采集次数平方增加,因此信噪比 (S/N) 会随着采集次数的增加而增加。因此,S/N 会随采集次数的平方增加,如图 7 所示。

2002 年诺贝尔化学奖部分授予库尔特·武特里希,以表彰他“对生物大分子结构和功能的 NMR 研究”。[1] 因此,NMR 对结构生物化学很重要。表 2 列出了与 NMR 波谱相关的发现而获得的诺贝尔奖。


NMR 是一种强大的技术,可以通过分析某些原子的相对位置来确定高度浓缩溶液中蛋白质的结构(Shriner 136)。蛋白质 NMR 利用碳和氧的最丰富同位素(12 和 16)以及氮 (14) 的丰富同位素的净核自旋为零这一事实,而氮 (14) 的净核自旋为 1。无法对净核自旋为零的原子进行 NMR。由于单个蛋白质中存在许多不同的原子核,因此在通过 NMR 分析产生的化学位移中预计会出现大量重叠,因此采用多维方法。通过电磁脉冲将磁化作用施加到蛋白质和原子核上,这些脉冲可以通过两种方式磁化原子核。第一种涉及通过原子核键合磁化,第二种涉及通过开放空间磁化。每种方法都提供了一种不同的分析蛋白质的方法,例如第一种方法允许针对不同的原子核,而第二种方法允许结构计算距离约束并针对未标记的蛋白质。
本身具有磁性的原子核表现出自旋特性,从而产生磁矩。当对系统施加外部磁场时,磁矩可以采用 α 态或 β 态。磁场强度决定了 α 与 β 的比例,倾向于有利于 α,因为它与场对齐并具有较低的能量。通过提供电磁脉冲,α 自旋原子核将变为 β 并产生共振。通过保持系统上的恒定磁场并调整电磁脉冲的频率,可以获得共振谱图。
目前,NMR 光谱仪使用脉冲辐射的傅里叶变换方法。为了将 α 态的原子核变为 β 态,使用强辐射脉冲。然后去除辐射脉冲,原子核回到其原始的 α 态,产生衰减信号。该信号由计算机以非常快的速度转换为频域谱图。通过存储多个信号,会产生更强烈的谱图。(Shriner 136)
磁性原子核周围的电子会产生一个局部磁场,该磁场与外加磁场方向相反。磁性原子核可以在特定频率下吸收电磁脉冲,这些频率被称为“化学位移”(信号位置),用百万分率 (ppm) 表示。这些化学位移是相对于标准化合物(例如四甲基硅烷 (TMS) 的衍生物 (CH3)4Si(化学位移为 0.0))来确定的,该化合物可溶于水。通过该分析产生的核磁共振谱可以进行分析,并结合多维分析确定蛋白质的结构。
当原子核受到磁场的影响时,它会产生一个磁矩,该磁矩会使其自身旋转。旋转的不同方向,即自旋状态,存在于不同的能量状态——α状态和β状态——其中α状态被发现更稳定,能量更低,因为通过实验发现它与磁场方向相同。为了使α状态转变为β状态(激发态),需要脉冲电磁辐射来增加电磁辐射的频率(通过照射),以使旋转的原子核克服能量势垒并改变其方向。(有关更多信息,请参见 玻尔模型)。因此,将获得共振。它是由美国物理学家爱德华·米尔斯·珀塞尔和瑞士物理学家菲利克斯·布洛赫于 1946 年发现的。
磁场分裂的能级差对应于无线电波的能量。因此,直到二战期间,政府大量投资雷达技术,才开发出核磁共振波谱仪所需的电子设备。雷达就是利用无线电波来探测移动物体的位置和方向。更好的频率合成器、放大器、接收器和信号处理器都有助于核磁共振波谱领域的发展。核磁共振波谱仪的组成部分如图 8 所示。

表 3 中显示了一些常见的二维实验。
| 常见的二维实验 (表 3) | |
|---|---|
| COSY | 相关谱 通过键 H-H 相关性 |
| TOCSY | 全相关谱 扩展通过键 H-H 相关性 |
| 一维 NOE | 核 Overhauser 效应谱 H-H 空间相关性 |
| NOESY | 核 Overhauser 效应谱 H-H 空间相关性 |
| ROESY | 旋转框架 Overhauser 效应谱 类似于 NOESY |
用于核磁共振的磁体非常强。用于高分辨率蛋白质结构测定的磁体频率范围为 500 兆赫兹至 900 兆赫兹,产生的磁场强度是地球磁场的数千倍。虽然样品暴露在强磁场中,但很少有磁力从机器中逸出。核磁共振磁体是超导体,因此必须用液氦冷却,液氦保持在 4 开尔文。液氮保持在 77 开尔文,有助于保持液氦的低温。
只有某些同位素适合用于核磁共振。核磁共振中最常用的同位素是氢-1(质子核磁共振)。其他常用的同位素是碳-13 和氮-15。
矢量模型仅适用于未耦合的自旋。在核磁共振波谱下活跃的原子核与其相关的核自旋磁矩相关联,这意味着这些原子核会产生微弱的磁场。当这些原子核置于磁场中时,相互作用的能量取决于磁场和磁矩之间的角度。当磁场和磁矩指向相反方向时,相互作用的能量最高;当磁场和磁矩指向相同方向时,相互作用的能量最低。在对原子核群体施加磁场之前,由于随机热运动,这些原子核的磁矩随机排列。施加磁场后,必须等待自旋达到平衡,这一过程称为弛豫。指向磁场方向在能量上略微有利,因此只有极少数的自旋会这样做,形成主体磁化矢量。因此,样品被磁化。在平衡时,主体磁化矢量将指向磁场方向(我们将假设它是 z 方向),并且是静止的。如果磁化矢量偏离轴线,它将以拉莫尔频率(-旋磁比 * 磁场)进动。脉冲的目的是快速改变磁化矢量的方向。这可以通过在所需方向上产生一个更弱的磁场来实现,但允许它以上述拉莫尔频率振荡。这将导致磁化矢量指向所需的方向。发生这种情况是因为当 B1 场(更弱的场)以拉莫尔频率附近振荡时,结果是 B0 场(z 方向上更强的场)的强度似乎降低了。因此,如果 B1 场远大于减小的场,则产生的磁场(有效场)可以指向非常接近 B1 场的方向。共振脉冲涉及通过在特定方向上施加 B1 场特定时间来改变磁化矢量的方向。磁化矢量旋转的角度等于有效场频率和脉冲施加时间的乘积。通过施加不同的时间,可以将磁化矢量旋转到不同的角度。对于实际的核磁共振实验,样品中将存在多个共振频率。如果使 B1 场足够强,则有可能将磁化矢量非常接近所需方向,这意味着我们可以将其接近于共振脉冲的理想情况。矢量模型可用于理解简单的核磁共振实验。
化学位移是蛋白质核磁共振分析图中使用的单位。化学位移与穿过蛋白质样品的不同射频电磁脉冲相关。每个表现出自旋特性的分子都显示出不同的化学位移。可以通过向蛋白质样品发送核磁能来观察化学位移。围绕每个自旋核的电子云会产生一个局部磁场,该磁场与外加磁场方向相反。当电磁脉冲穿过样品时,α自旋核被正确的能量击中以切换到β自旋,然后它们这样做并随后引起共振。这种共振随后可以被记录下来,并且被报告为以百万分率 (ppm 化学位移) 应用于样品的不同频率。例如,当核磁场强度发出 1 ppm(百万分率)的频率时,CH3 对其做出反应,并表现出β自旋行为,从该行为中,光谱捕捉到该信号并将其记录下来。
在 300-MHz 1H 核磁共振中,大多数氢吸收落在 3000 Hz 的范围内。我们不是记录每个共振的精确频率,而是相对于内部标准物四甲基硅烷 (CH3)4Si 来测量它。它的 12 个等效氢相对于大多数有机分子中的氢来说是屏蔽的,从而导致共振线方便地移出通常的光谱范围。然而,这些数字的问题是它们会随着外加磁场强度的变化而变化。由于场强和共振频率成正比,因此将场强度加倍或三倍将使观察到的峰相对于 (CH3)4Si 的距离(以赫兹为单位)加倍或三倍。为了便于比较已报道的文献光谱,我们通过将到 (CH3)4Si 的距离(以赫兹为单位)除以波谱仪的频率来标准化测量的频率。此过程产生一个与场无关的数字,即化学位移 δ。
核磁共振谱使用超导磁体来研究许多金属核。由于其天然丰度低和核磁共振实验灵敏度低,碳 13 核磁共振在促进研究方面越来越有用。整合有机金属配合物的核磁共振峰可以提供不同环境中原子比例的信息。由于有机金属化合物中碳原子的弛豫时间不同,因此会产生很大的误差。但它也有自身的优势。例如,末端羰基峰通常在 195 到 225ppm 的范围内,这使得它很容易与其他配体区分开来。13C 化学位移与 CO 键强度相关。键越强,化学位移越小。环戊二烯基配体中的 13C 在顺磁性化合物中具有很宽的化学位移范围,而在抗磁性化合物中则更窄。
在核磁共振中,某些原子核必须天生具有磁性,才能使用此技术。但是,只有某些同位素具有这种称为自旋的磁性特征。一个例子是氢。当施加外磁场时,氢的自旋质子会产生一个磁矩,该磁矩可以处于 α 或 β 自旋状态。两种状态之间的能量差与施加的外磁场量成正比。α 状态与施加的场对齐,能量低于 β 状态。当对 α 状态施加电磁辐射脉冲时,它可以被激发到 β 状态,从而获得共振。
核磁共振只能检测某些原子,并且只能检测某些同位素。例如,它可以检测质量为 1 amu 的氢分子,但不能检测其他同位素。最常用的是氢和碳核磁共振。核磁共振可以确定的信息非常多。在氢核磁共振的情况下,可以使用表格中的一些知识来确定每个峰对应于样品中的哪个基团。解释核磁共振可能有点棘手,因为必须理解裂分模式。例如,您可能正在检查的碳原子可能只有一个氢原子连接,但是如果连接到一个甲基,它将显示为一个四重峰。
屏蔽和去屏蔽
[edit | edit source]处于不同化学环境中的质子受到不同程度的屏蔽。当一个被电子包围的原子核暴露在强度为H0的磁场中时,这些电子以产生一个小局部磁场hlocal的方式移动,该磁场与H0相反。因此,氢核附近的总磁场强度减小,因此可以说该原子核被其电子云屏蔽了磁场强度。屏蔽程度取决于原子核周围的电子云密度。增加电子会增加屏蔽;相反,去除电子会导致脱屏蔽。此外,当感应磁场增强外加磁场时,质子会发生脱屏蔽。例如,感应磁场可以增强外加磁场。结果,这些质子脱屏蔽,它们的化学位移在更高的ppm值处。
耦合
[edit | edit source]J-耦合源于不同自旋态通过分子化学键的相互作用,导致NMR信号分裂。这种耦合提供了关于原子连接性和分子结构的详细信息。自旋-自旋分裂由N+1规则给出:1)与一个H相邻的H共振为双峰。2)与两个组等效的H相邻的H共振为三峰。3)与三个等效的氢相邻的H共振为四重峰。
当存在耦合模式的混合时,可以显示多重峰,其中一些可以分解成小部分(例如,qd-双峰四重峰)。但在大多数情况下,如果耦合模式显示出无法通过N+1规则轻松计数的复杂性,则这种模式称为多重峰。此外,含有醇(-OH)官能团的醇,如醇,羧酸在NMR谱图上具有宽带。这是因为醇上的氢可以很容易地形成氢键,因此能够在比其他H更宽的谱图中耦合。因此,仅通过查看谱图的类型(例如多个峰或宽峰),就可以轻松地对H所关联的官能团进行分类。
分裂峰的比例由一个称为帕斯卡三角形的数学助记符给出。该三角形中的每个数字都是它上方一行中两个最接近数字的总和。重要的是要记住,不等价的核相互分裂。换句话说,观察到一个分裂吸收需要在光谱中存在另一个分裂信号。此外,这些模式的耦合常数必须相同。双键和三键的特征化学环境显示出复杂的裂峰。例如,炔烃可以具有额外相邻碳原子远离的氢分裂模式。烯烃根据氢相对于相对化学环境的位置(顺式或反式),可以显示出略微扭曲的峰。
积分
[edit | edit source]积分在NMR谱图中非常有用,可以确定分子的结构。信号的相对积分强度与产生该吸收的核的相对数量成正比。通常,NMR谱图会显示非常复杂的积分数。但是,积分并不需要完全准确。你只需将每个积分数除以NMR谱图中最小的数字即可。该比率将帮助你了解由峰表示的H的相对数量。结合化学位移和峰积分,你可以使用化学位移表确定分子的结构。研究人员通常使用NMR来检查他们从反应中得到的产物是否正是他们想要的。因此,他们不必通过查看复杂的光谱来确定分子的结构。他们知道如果反应有效,光谱应该是什么样子。通过将实际光谱与理想光谱进行比较,他们能够验证他们想要的分子是否在产物中。使用的溶剂通常是CD2Cl2,因为D在H NMR谱图中不会显示出来。结合化学位移,它们可以用来确定结构。
质子NMR解释
[edit | edit source]为了解释质子NMR,重要的是要知道每种类型的质子位于何处。下面列出了质子的类型及其在NMR上的化学位移。
重要的是要知道,质子NMR峰仅指示质子(H)的存在。它不显示其他原子,如碳、氧等。如上文所述,质子峰由于与相邻质子的耦合而显示分裂。每个峰的积分是质子相对于NMR上其他质子的数量。在从H NMR中解决结构时,重要的是写下每个峰的化学位移、积分和分裂。然后根据峰的化学位移,写下可能的官能团和结构。最后,排列和连接每个结构,使其与质子NMR的分裂和积分相匹配。以下是手绘制的质子NMR的示例以及解释质子NMR的详细说明。
示例
[edit | edit source]每个质子NMR的解释直接在每个图表下方给出。尽量不要看结构,只看分子式和质子NMR来解释化合物的结构。请注意,给出的例子是基础和简单的化合物。蛋白质结构的NMR比这些例子复杂得多。这些例子的目的是让你了解质子NMR是如何解释的。
根据质子NMR的化学位移,应该有一个酮官能团或包含羰基的结构,在约2.0的峰值处。约1.3的峰值可能是伯烷基或仲烷基。
现在看一下化学位移1.3 (C) 处的峰值分裂,三峰(3个峰)表明质子可能被2个相邻质子分裂(基于积分部分中提到的n+1规则)。如果它只被1个相邻质子分裂,那么它将是双峰(2个峰)。接下来,看一下化学位移2.0 (B) 处的峰值。单峰(单个峰)意味着该质子环境可能没有相邻质子。化学位移4.2 (A) 处的峰值是四重峰(4个峰)。这意味着质子环境A附近大约有3个相邻质子。由于已知B在其旁边没有质子,而A和C都有相邻质子,因此可以安全地假设质子环境A就在质子环境C旁边,这可能是-CH2CH3。上面推断出的以下可能结构是酮和乙基。
| 亚结构 | 
|

|
|---|---|---|
| 分裂模式 | 单峰 | 四重峰和三峰 |
| 分析 | C没有相邻的H | C有三个相邻的H C有两个相邻的H |
请注意,分子式中有两个氧原子。其中一个氧原子包含在酮中。另一个氧原子必须连接到这两个结构之一。看一下峰A,化学位移接近4.0,这意味着它可能连接到像氧这样的杂原子。将氧原子放在-CH2CH3旁边,并将结构连接在一起,你将得到乙酸乙酯,如质子NMR下方所示。请注意,质子B没有相邻质子。质子A被质子C分裂成4个峰(n+1规则,n = 3个相邻质子)。质子C被质子A分裂成3个峰(n = 2个相邻质子)。CH2,仲烷基,根据质子频率表,应该在约1.2 ppm的化学位移附近,但实际上它在约4.2 ppm处。造成这种情况的原因是CH2连接到氧,氧是一种吸电子基团。结果是化学位移被拉到了左场,导致4.2 ppm的化学位移。另一种看待这个问题的方法是假设在4.2 ppm的化学位移处存在一个酯官能团,伯烷基连接到酯。质子NMR的积分也与结构很好地匹配。羰基旁边的甲基CH3有3个质子,CH2旁边的伯烷基也有3个质子。这解释了为什么峰B与峰C的高度相同(相同的质子数量)。峰A的高度最低,因为它只有两个质子。
 这个质子核磁共振谱例子看起来比第一个复杂,但实际上更容易。从这个质子核磁共振谱中得到的一个重要信息是,在 6.0~ 7.0 ppm 附近有峰(F,B,D,E)。这几乎总是表明芳香环的存在。注意到从 6.0 到 7.0 ppm 有大约 4 组峰?这意味着有四个质子连接到芳香环上的 4 个碳原子上。这使得芳香环的 2 个碳原子可以自由连接到两个取代基上。这些取代基的位置显然是芳香环上的邻位和对位。原因是芳香环上邻位和对位上的两个不同取代基会给出 4 种质子环境。如果在 6.0~ 8.0 ppm 附近只有两种质子环境,并且积分(高度)相同,这意味着芳香环可能在两侧对称,具有双对位取代基。现在看一下 5.5 ppm 处的峰(A)。该峰是宽峰,而不是像其他峰一样的尖锐峰。这意味着该环境的质子连接到杂原子。根据给出的分子式,样品中存在的唯一杂原子是氧原子。这意味着质子直接连接到氧原子,这将是一个醇基团 -OH(注意,醇基团上的质子可以具有从 0.5 到 5.0 ppm 的化学位移范围)。重要的是要记住,连接到杂原子的质子也被称为可交换质子。可交换质子有时不会出现在 H NMR 上,所以当预期的可交换峰没有出现在 HMNR 上时不要担心。化学位移约为 3.9 ppm 的峰(C)具有最高的积分(高度)并且是单峰。通常,当在分子式中含有氧原子时,在 3.9 ppm 附近观察到如此高的单峰时,很有可能是一个醚基团,-OCH3。由于醚的 CH3 旁边没有相邻质子,所以它是单峰。此外,该峰的高度与其他峰相比很高,这表明可能存在 CH3,其质子数至少是其他质子环境的 3 倍。根据以上解释,这些是可能的官能团:
这个质子核磁共振谱例子看起来比第一个复杂,但实际上更容易。从这个质子核磁共振谱中得到的一个重要信息是,在 6.0~ 7.0 ppm 附近有峰(F,B,D,E)。这几乎总是表明芳香环的存在。注意到从 6.0 到 7.0 ppm 有大约 4 组峰?这意味着有四个质子连接到芳香环上的 4 个碳原子上。这使得芳香环的 2 个碳原子可以自由连接到两个取代基上。这些取代基的位置显然是芳香环上的邻位和对位。原因是芳香环上邻位和对位上的两个不同取代基会给出 4 种质子环境。如果在 6.0~ 8.0 ppm 附近只有两种质子环境,并且积分(高度)相同,这意味着芳香环可能在两侧对称,具有双对位取代基。现在看一下 5.5 ppm 处的峰(A)。该峰是宽峰,而不是像其他峰一样的尖锐峰。这意味着该环境的质子连接到杂原子。根据给出的分子式,样品中存在的唯一杂原子是氧原子。这意味着质子直接连接到氧原子,这将是一个醇基团 -OH(注意,醇基团上的质子可以具有从 0.5 到 5.0 ppm 的化学位移范围)。重要的是要记住,连接到杂原子的质子也被称为可交换质子。可交换质子有时不会出现在 H NMR 上,所以当预期的可交换峰没有出现在 HMNR 上时不要担心。化学位移约为 3.9 ppm 的峰(C)具有最高的积分(高度)并且是单峰。通常,当在分子式中含有氧原子时,在 3.9 ppm 附近观察到如此高的单峰时,很有可能是一个醚基团,-OCH3。由于醚的 CH3 旁边没有相邻质子,所以它是单峰。此外,该峰的高度与其他峰相比很高,这表明可能存在 CH3,其质子数至少是其他质子环境的 3 倍。根据以上解释,这些是可能的官能团: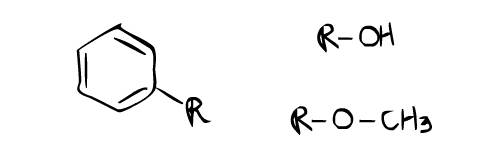
将醇基团和醚基团连接到邻位-对位位置将导致该化合物的正确结构。
核Overhauser效应谱 (NOESY)
[edit | edit source]
NOESY 是一种核磁共振技术,它利用核 Overhauser 效应来帮助理解蛋白质和其他大分子三级结构。核 Overhauser 效应是指彼此距离很近的原子核之间的相互作用。该效应的程度大约为 5 埃。对于不能形成晶体结构而需要在溶液中分析的蛋白质来说,这是一种更好的三级结构分析方法。就像在核磁共振中一样,在分子周围产生一个磁场,并产生不同频率的射频波来产生共振。当原子核反转自旋时,就会产生共振。与普通核磁共振不同,NOESY 的目的是确定一个原子核的共振对该区域中其他原子核的影响。产生的图谱可以让你了解原子核彼此之间的相对位置。
NOESY 实验揭示了质子彼此之间的距离。彼此非常靠近的质子(大约 3 埃)会产生非常强的信号。检测限大约是 5-6 埃,只会产生非常微弱的信号。
该图谱具有对角线上的点,这些点对应于原子核在一维核磁共振谱上的位置。对角线谱外也有点。这些点显示了哪些原子核彼此靠近。如果从外点水平和垂直画一条线,则对角线谱上的线上的点彼此靠近。利用来自核磁共振和 NOESY 的信息,可以形成大分子的三级结构。然而,所得到的三级结构将包含一系列结构。出现这种情况有三个原因。第一个是原子核之间距离的近似值。其次,可能没有足够的约束条件来产生单一的结构。第三,蛋白质处于溶液中,而溶液中包含许多蛋白质。
这种技术主要用于氢原子,因为它们是生物系统中最丰富的原子,也是最简单的原子。
蛋白质核磁共振
[edit | edit source]核磁共振仪本质上是一个巨大的磁铁。许多原子本质上都是微小的磁铁。当放在核磁共振仪中时,所有微小的磁铁都会排列起来,与大磁铁对齐。通过利用这一物理定律,核磁共振光谱学家能够弄清楚有关分子物理、化学、电子和结构的信息。
核磁共振依赖于施加的磁场与某些原子核中天然存在的“微小磁铁”之间的相互作用。对于蛋白质结构测定,光谱学家专注于蛋白质中最常见的原子:氢、碳和氮。研究人员通过核磁共振试图了解的是,这条氨基酸链是如何围绕自身缠绕和折叠,从而形成三维的活性蛋白质。使用核磁共振解决蛋白质结构是一系列实验,每个实验都提供有关样品分子中原子性质的部分线索,例如两个原子彼此之间有多近,这些原子是否物理结合在一起,或者这些原子位于同一个氨基酸中的哪个位置。其他实验显示相邻氨基酸之间的联系,或揭示蛋白质中灵活的区域。每组新的实验都会进一步细化可能的结构,直到最后科学家仔细选择 10 到 20 个最能代表其数据的解决方案,并呈现平均值作为其最终结构。
核磁共振样品制备
为了通过核磁共振研究蛋白质结构,必须制备感兴趣蛋白质的高度纯化的样品。蛋白质可以从天然来源中分离出来,也可以通过重组 DNA 技术在宿主生物体(如大肠杆菌)中表达。含有编码特定蛋白质的重组基因的细菌在用 15NH4Cl 作为细菌唯一氮源的最小培养基中生长,而 13C-葡萄糖为细菌制造蛋白质提供唯一碳源。这样,当细菌产生目标蛋白质时,这些蛋白质被标记为 15N 和 13C,这两者都是核磁共振活性。然后通过各种蛋白质纯化技术纯化目标蛋白质(参见蛋白质纯化技术)。最后,将蛋白质在适当的缓冲液中装入核磁共振管中,并准备放入核磁共振磁铁中。

核磁共振实验
二维实验 可以进行许多不同类型的核磁共振实验来帮助揭示有关蛋白质结构的信息。这些实验通常在检测到的相关性方面有所不同。例如,二维 [1H-1H]-NOESY 实验将揭示距离在 0.5 纳米内的氢原子。表现出这种相互作用的质子将在二维谱图上显示为交叉峰(图 2)。

从理论上讲,利用这些信息,可以将 1D 谱图上 8 ppm 和 9 ppm 处的质子分配给氨基酸序列中的特定残基。例如,如果 Ala1 是 8 ppm 处的点,Ala54 是 9 ppm 处的点,并且存在交叉峰,那么观察到这种 NOE 揭示了该多肽链的环状结构(图 3)。

由于蛋白质比上面的例子复杂得多,二维 NOESY 谱图通常杂乱无章,交叉峰无法清晰地识别出来,因为许多这些点可能会堆叠在一起。需要其他实验来揭示确定蛋白质 3D 结构所需的信息,例如 3D 实验。
三维实验 三维实验使用第三维来揭示可能在二维谱图中堆叠在一起的峰。一个例子是三维 15N 相关 [1H-1H]-NOESY(图 4)。还有许多其他实验可以关联不同的原子核及其邻居。

蛋白质核磁共振优势
[edit | edit source]核磁共振是一种很好的方法,可以尝试解决蛋白质结构以及持续不断的未解蛋白质折叠问题。然而,它不是唯一的方法,因为晶体学也是一种可能的蛋白质结构测定方法。然而,核磁共振比晶体学有其优势。
一个例子是它使用溶液中的分子,因此它不局限于那些结晶良好的分子,因为结晶是 X 射线晶体学中一个非常不确定且耗时的步骤。此外,一些蛋白质不容易结晶。此外,虽然结晶蛋白质中存在的结构非常接近于不受晶体环境约束的蛋白质的结构,但溶液中的结构可能是额外见解的来源。核磁共振还使研究分子结构以外的性质变得相当容易,例如分子的柔性和它如何与其他分子相互作用。对于晶体学,要么无法研究这些方面,要么需要一个全新的晶体。
大多数核磁共振光谱学家专注于不超过 20-30 千道尔顿的分子。X 射线晶体学家已经解析了高达 2,500 千道尔顿的结构。
2004 年分离出存在于葡萄籽中的 15 个碳化合物 Viniferone。Viniferone 属于葡萄籽中的一类物质,对自由基和氧化应激非常活跃。从大量的葡萄籽中回收的 Viniferone 很少(10.5 公斤葡萄籽中约 40 毫克 Viniferone),因此必须在用于获得其结构的技术中采取预防措施。大多数测试会破坏获得的微量原花青素 Viniferone,因此采用了一系列光谱技术(包括核磁共振)来获得 Viniferone 的结构。获得1H 和13C 核磁共振数据对于确定 Viniferone 的结构至关重要。各种在不同化学位移下的吸收信号有助于确定烯烃和苯环的存在。相关光谱学,最终的 X 射线晶体学被用来验证 Viniferone 的结构排列。[1]
- ↑ Schore, Neil E. (2011)。有机化学结构与功能 第 6 版。W. H. Freeman
如果您想了解更多关于解释核磁共振峰的信息,我强烈建议您访问此网站。 http://www.wfu.edu/~ylwong/chem/nmr/h1/
Berg, Jeremy M., Lubert Stryer 和 John L. Tymoczko。生物化学。第 6 版。波士顿:W. H. Freeman & Company,2006。98-101。
Shriner, Christine K. F. Hermann, Terence C. Morrill, David Y. Curtin, Reynold C. Fuson。有机化合物的系统鉴定。第 8 版。美国。John Wiley & Sons, Inc. 2004。136-142。
Vollhardt, K. Peter C.,Schore, Neil E. 有机化学 - 结构与功能。第 5 版。纽约:W. H. Freeman & Company,2005。398-432。
Keeler, James。理解核磁共振光谱学。西萨塞克斯,英国。John Wiley & Sons。51-77。
Clore, Marius G.,Gronenborn, Angela M. “第 34 章:通过多维异核核磁共振确定较大蛋白质、蛋白质-配体和蛋白质-DNA 复合物的结构”。溶液状态的多维核磁共振方法。英国。John Wiley & Sons Ltd.
Wuthrich, Kurt。 “第 33 章:生物大分子:溶液中的结构测定”。溶液状态的多维核磁共振方法。英国。John Wiley & Sons Ltd.
美国国立卫生研究院,美国国立普通医学科学研究所,纽约,2007,29-30,http://www.nigms.nih.gov.
[1]"Kurt Wüthrich - 诺贝尔演讲"。Nobelprize.org。2010 年 10 月 25 日 http://nobelprize.org/nobel_prizes/chemistry/laureates/2002/wuthrich-lecture.html


