结构生物化学/蛋白质/剪接蛋白的信号控制
测序和微阵列技术方面的进步使我们能够更好地理解不同细胞中前 mRNA 剪接模式。例如,当细胞受到诸如 DNA 损伤、神经元去极化或细胞代谢变化等因素刺激时,细胞剪接会发生变化。在过去几年中,关于将细胞刺激与下游可变剪接控制相关联的机制模式的研究越来越多。这些剪接事件中的一些包括剪接因子的降解、核易位改变以及剪接因子的调控合成。
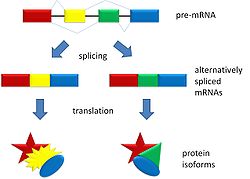
可变剪接是在基因表达过程中发生的一种过程,它允许从单个基因编码产生多个蛋白质(蛋白质亚型)。可变剪接可能由于外显子从信使 RNA 中排除或包含的不同方式而发生。它也可能发生在当外显子的一部分被排除/包含或内含子被包含时。例如,如果前 mRNA 有四个外显子(A、B、C 和 D),则这四个外显子可以以多种不同的组合进行剪接和翻译。外显子 A、B 和 C 可以一起翻译,或者外显子 A、C 和 D 可以翻译。这就是导致可变剪接的原因。
剪接模式和可变剪接信使 RNA 的产生是由调控蛋白(含有基因的反式作用蛋白)与位于前 RNA 上的顺式作用位点结合控制的。这些调控蛋白中的一些包括剪接激活剂(促进特定剪接位点的蛋白质)和剪接抑制剂(降低特定位点使用率的蛋白质)。一些常见的剪接抑制剂包括:异质核核糖核蛋白 (hnRNP) 和多嘧啶区结合蛋白 (PTB)。从可变剪接信使 RNA 翻译的蛋白质在氨基酸序列上有所不同,这导致蛋白质功能发生改变。这就是人类基因组能够编码多种蛋白质的原因。可变剪接是真核生物中常见的一种过程;人类中大多数多外显子基因都是可变剪接的。不幸的是,剪接的异常变化也是导致许多遗传疾病和疾病的原因。

信使 RNA 的剪接是通过称为剪接体的巨型分子复合体完成和催化的。连接和切割的区域由剪接体的许多亚基决定。这些亚基包括分支位点 (A) 以及 5' 和 3' 剪接位点。这些亚基与剪接体中发现的小核核糖核蛋白 (snRNP) 之间的相互作用形成了剪接体 A 复合体,它有助于确定哪些内含子要排除在外,哪些外显子要保留并连接在一起。一旦内含子被切割和移除,外显子就会通过磷酸二酯键连接在一起。
如上所述,剪接受抑制蛋白和激活蛋白的调控,这些蛋白也称为反式作用蛋白。同样重要的是在信使 RNA 上发现的沉默子和增强子,也称为顺式作用位点。这些调控功能共同作用以创建确定可变剪接的剪接代码。顺式作用位点将在此处讨论。

剪接沉默子是在前信使 RNA 中发现的调控位点,剪接抑制蛋白与之结合。当抑制蛋白与沉默子位点结合时,它会降低选择附近位点作为剪接连接的可能性。这些沉默子位点可以在内含子或外显子上找到。当位于内含子上时,这些位点被称为内含子剪接沉默子,而在外显子上被称为外显子剪接沉默子。在这些位点上发现的序列数量众多,这使得不同类型的蛋白质能够结合。

另一方面,剪接增强子是剪接激活蛋白可以与之结合的调控位点。当激活蛋白与增强子位点结合时,它会增加选择附近位点作为剪接连接的可能性。就像剪接沉默子一样,这些位点也可以在内含子和外显子中找到。在内含子中,它们被称为内含子剪接增强子,而在外显子中被称为外显子剪接增强子。但是,与它们的沉默子对应物不同,增强子位点通常允许激活蛋白的结合,这些激活蛋白属于 SR 蛋白家族。这些蛋白质富含精氨酸和丝氨酸。
某些特定信号如何调控可变剪接?最近发现可变剪接几乎发生在所有人类基因中。最典型的是,当发生可变剪接时,特定外显子可能在不同的细胞类型或生长条件下被包含或排除。在每种情况下,剪接模式、调控蛋白与顺式作用辅助序列的结合通常决定剪接模式,而这些序列反过来控制结合发生的位置和/或酶复合体在邻近剪接位点处的反应方式。(可变剪接的组合调控)重要的是,由此产生的 mRNA 的开放阅读框或控制 mRNA 稳定性或翻译的顺式调控元件的存在可以通过上述任何一种差异模式改变。因此,塑造任何给定细胞的蛋白质组需要精确控制可变剪接,而细胞功能对不断变化的环境条件的响应方式也可以通过剪接模式的变化而发生显著改变。

可变剪接的组合调控 剪接体是一种催化内含子去除和外显子基本连接的巨型分子复合体。为了对前 mRNA 中内含子和外显子边界处的序列元素进行排序,各种剪接体亚基的结合决定了连接和切割的确切位点。这些亚基是 5' 剪接位点、分支点序列、富含嘧啶的轨迹和 3' 剪接位点。然而,对于哺乳动物来说,剪接位点是高度保守的;因此,它们通常不足以以高亲和力结合剪接体。通过机制结合剪接体的效率可能会受到结合到外显子或内含子中非剪接位点序列的蛋白质的影响。外显子或内含子剪接增强子是帮助促进剪接体识别外显子的序列,而剪接沉默子则是抑制外显子识别的必要条件。外显子包含(绿色椭圆形)通过普遍表达的 SRSF 蛋白家族成员的增强子结合得到促进,而外显子使用通过 hnRNP 蛋白家族成员通过沉默子元件(红色椭圆形)抑制。FOX、CELF、神经肿瘤腹侧抗原 (NOVA) 和类肌盲 (MBNL) 蛋白是一些其他组织限制性更高的剪接调节因子,这些调节因子通过仍然很大程度上未定义的机制作为增强子和剪接抑制因子同样起作用。因此,单个调控蛋白的结合或表达平衡的细微变化通常会改变 mRNA 亚型表达的比例。
-
神经肿瘤腹侧抗原 1
-
类肌盲剪接调节因子 1
剪接蛋白的翻译后修饰
在许多情况下,磷酸化、乙酰化、甲基化、SUMO 化和羟基化参与剪接调节蛋白的修饰。在 SR 蛋白中发现的广泛 Arg-Ser 二肽的磷酸化是表征最充分的修饰。广泛的翻译后修饰还包括 HnRNP 蛋白,以及其他非 SR 剪接因子。

近年来,诸如深度测序和敏感微阵列等技术工具为我们揭示了更多关于可变剪接事件的知识。几乎所有的人类基因都经历某种形式的可变剪接,包括特定外显子的差异排除或包含,外显子部分的排除,以及内含子和外显子的包含。这些差异趋势可以改变加工后的mRNA的阅读框架,或者改变任何监控mRNA翻译或稳定性的顺式调控因子。因此,可变剪接的调控对于塑造细胞蛋白质组至关重要;剪接模式的改变可以改变细胞响应环境变化的功能。心脏组织发育阶段、神经元去极化前后以及细胞凋亡前后观察到的结果表明,可变剪接事件在信号传导和发育过程的功能结果中起着重要作用。
由于可变剪接通常由调节蛋白结合到控制结合位置和附近剪接位点酶复合物活性的辅助序列来决定,因此它被用于响应DNA损伤和T细胞活化。一个关于DNA损伤的例子包括E3泛素连接酶鼠双分钟-2(MDM2)的可变剪接。MDM2通过靶向p53(一种抑癌基因)使其发生蛋白酶体降解,从而特异性地控制p53的水平。一旦感知到DNA损伤,Mdm2的外显子就会被跳过,从而减少MDM2的功能,因此允许p53积累。这种诱导的MDM2调控提供了一个例子,说明如何将剪接与转录相耦合,因为外显子跳过模拟了受损的DNA。在这种情况下,细胞表现出“对可变剪接的严格控制,这有助于调节蛋白质表达,因为细胞中的条件正在变化”。[3]
改变蛋白质的相互作用是实现可变剪接的另一种方法。T细胞活化的一个证明就是这种情况。在T细胞活化中,可变剪接类似于DNA损伤,其中改变的蛋白质与其他蛋白质的相互作用调节特定T细胞活化期间CD45基因的剪接。在静息T细胞中,RNA结合蛋白PSF被酶GSK3磷酸化,这会导致磷酸化的PSF与TRAP150形成复合物。结果,PSF不能结合到CD45 RNA。这阻止了任何可能的外显子排除,导致不参与剪接。然而,在活化的T细胞中,由于抗原与T细胞受体结合并导致GSK3活性下降,因此GSK3很少或没有。没有GSK3,PSF不会与TRAP150结合,并且可以自由地结合到RNA。这是一个主要的例子,说明剪接是如何由信号诱导的转录变化控制的。
RNA结合蛋白调控剪接
[edit | edit source]改变调节蛋白的表达水平是影响可变剪接的最简单方法。由于对给定转录本的复杂影响,一个剪接因子的表达发生微小变化就会改变决定外显子排除或包含的元件。已证明信号通路可以改变核因子-κB和T细胞核因子等转录激活因子的控制。因此,信号诱导编码SR蛋白或其他剪接调节因子的基因的转录,从而改变响应这些因子的基因的剪接。在一个实例中,有人提出T细胞的刺激会触发编码酪氨酸磷酸酶CD45的基因的剪接信号。此外,PTB相关剪接因子和hnRNP L样蛋白激活CD45外显子4和6的消除。有趣的是,蛋白质表达的诱导变化不仅仅来自转录。如剪接调节蛋白CELF1所示,其蛋白质水平的增加是由于CELF1稳定性和磷酸化的增加,这导致了总体上调的稳态水平。这种磷酸化增加也负责DM细胞中的蛋白激酶C活性。不出所料,蛋白质稳定性的增加还有其他调控;它也受到心脏发育过程中miRNA的控制。这两个耦合机制突出了这样一种观点,即调节调节蛋白表达对于维持细胞功能所需的适当剪接模式至关重要。[3]
RNA结合蛋白的定位
[edit | edit source]除了上面提到的蛋白质表达和稳定性方法之外,当由于调节蛋白的定位而发生信号变化时,也会发生可变剪接。许多调节蛋白,如上面提到的SR蛋白和hnRNP,必须在细胞核和细胞质之间来回穿梭。结果,这些调节蛋白在细胞核和细胞质中的相对分布会改变信号通路。这些改变的通路将导致剪接差异。两种其分布受调控的调节蛋白包括SRPK1和hnRNP蛋白(特别是hnRNP A1)。在SRPK1的情况下,这种调节蛋白通常由于与热休克蛋白的相互作用而存在于细胞质中。然而,当细胞发生渗透性休克时,SRPK1蛋白会转移到细胞核,并导致SR蛋白的磷酸化。这种磷酸化导致蛋白质与其靶基因之间不同的相互作用,并产生不同的剪接模式。在hnRNP的情况下,渗透性休克实际上对这种蛋白质的定位具有与SRPK1相反的影响。hnRNP通常也存在于细胞质中,但与SRPK1相反,渗透性休克不会导致它转移到细胞核。实际上,hnRNP的磷酸化阻止其进入细胞核。
可变剪接中的反馈回路
[edit | edit source]
由于所有生物都经历稳态,细胞也是如此。为了让细胞进行稳态,它们必须在条件恢复正常后关闭诱导的剪接信号。例如,这些调控可能包括去除抗原、DNA修复和神经元复极化。重置基因表达的一种方法是通过去除初始受体或信号因子本身来停用信号。当然,诸如磷酸酶和激酶之类的受体会经历自抑制信号诱导的可变剪接。例如,响应T细胞活化,CD45的可变剪接将降低细胞对接受抗原刺激信号的敏感性。在另一个例子中,编码负责T细胞信号激活的激酶的分子,例如FYN原癌基因、信号调节激酶-1和酪氨酸激酶2β蛋白,由于T细胞活化而经历可变剪接,以减少表达或改变定位模式。
诱导相反调节因子的表达可以帮助重置诱导的剪接信号。神经元慢性去极化就是一个例子,这会导致由CaRRE控制的外显子跳过增加。一些这些CaRRE减少的外显子在长时间去极化中再次出现。这种剪接模式与CaMK诱导的FOX1的可变剪接有关,FOX1编码RNA结合蛋白。FOX1调节参与突触活动的基因的剪接模式。此外,许多由CaRRE控制的基因也具有FOX1结合位点,这可能对外显子包含产生与CaRRE序列相反的拮抗作用。由于大多数研究只调节少数基因,因此需要进行更多研究才能更全面地了解在给定通路的下游发生的可变剪接。[3]
蛋白质剪接的下一步是什么?
[edit | edit source]尽管上面提到了刺激因素,但对信号通路如何调节可变剪接的整体图景还远远没有完整。这些信号通路的研究所处阶段仍然非常早。这里介绍的方法通常对应于仅少数基因的可变剪接。因此,为了了解整个通路的可变剪接,还需要取得更多进展。
参考文献
[edit | edit source]1. Black, Douglas L. (2003). "可变前信使RNA剪接机制”。生物化学年度评论 72 (1): 291–336。
2. Clark, David (2005). 分子生物学。阿姆斯特丹:爱思唯尔学术出版社。
3. Heyd, Florian和Kristen W. Lynch. DEGRADE, MOVE, REGROUP: 信号控制剪接蛋白 费城:生物化学趋势,2011。打印。
4. Matlin, AJ;Clark F,Smith, CWJ (2005年5月)。“理解可变剪接:走向细胞代码”。自然评论 6 (5): 386–398。
5. Nilsen, T.W. 和 Graveley, B.R. (2010) 可变剪接扩展真核生物蛋白质组。自然 463, 457-463。
6. Pan, Q;Shai O,Lee LJ,Frey BJ,Blencowe BJ (2008年12月)。“通过高通量测序深入调查人类转录组中可变剪接复杂性的”。自然遗传学 40 (12): 1413–1415。
7. 图片:维基媒体公社
8. Heyd F, Lynch KW. 趋势生化科学. 2011年8月;36(8):397-404. Epub 2011年5月17日。评论。2. PMID: 21596569 [PubMed - 编入MEDLINE]
9. Barash, Y;等 (2010)。“破译剪接代码”。自然 465 (7294): 53–59。
10. Wang, Z;Burge, Cb (2008)。“剪接调控:从调控元件的零件清单到综合剪接代码”