结构生物化学/蛋白质被脂肪酸修饰
蛋白质被脂肪酸修饰,在半胱氨酸残基上,引起疏水相互作用。这是一种非常重要的蛋白质翻译后修饰,通过使蛋白质-蛋白质相互作用、信号转导和许多其他蛋白质功能成为可能,从而使蛋白质多样化。其中一个广为人知的脂类连接蛋白是 G 蛋白 1。蛋白质遵循的途径现在正被清晰地理解。多药耐药 (MDR) 基因的发现改变了细胞靶向蛋白质的方式。另一个重大发现是发现了一些蛋白质表面存在的小型脂肽。蛋白质的脂类修饰在真核细胞中很重要,因为它们增加了柔韧性和蛋白质特异性。真核细胞存在三种共价脂类修饰:肉豆蔻酰化、棕榈酰化和异戊烯化。
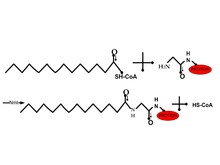
许多细胞肽与一个罕见的 14 碳链(酰化)共价连接到甘氨酸的酰胺键上。由于这种修饰主要在胞质溶胶中观察到,因此疏水功能并非这种修饰的唯一功能。N-肉豆蔻酰基转移酶从酵母和哺乳动物中纯化出来。由于溶解性和催化作用,去除内部 Met 后,可以使用肉豆蔻酰辅酶 A 来实现。与疏水区域 2 相比,酰基链在酶的效用中起着更重要的作用。在体内,亚甲基的替换与 S 或 O 因此使其更亲水。因此,这会改变蛋白质在膜中的分布。这可用于靶向药物递送2。
这涉及半胱氨酸残基上的硫酯键和初级棕榈酸。然而,由于难以纯化不稳定(膜结合棕榈酰基转移酶),因此调节该过程的机制知之甚少。另一个挑战是棕榈酰辅酶 A 是一种极好的酰基供体,但不需要满足任何蛋白质序列规格。然而,已经观察到目标位点位于细胞质侧的跨膜区域附近。许多位于细胞质区域附近的蛋白质都被棕榈酰化2。
这是一种在 C 端的三联体修饰,取决于基序 CAAX(C,半胱氨酸;A,脂肪族氨基酸;X,任何氨基酸)的初级序列。第一步是在半胱氨酸残基上添加异戊二烯脂类法呢醇,这将添加第 15 个碳。第二步是蛋白水解去除 AAX 并对 α-羧基进行羧甲基化2。
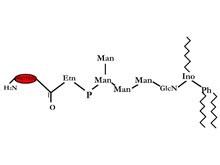
GPI 锚定蛋白是通过锥虫可变表面糖蛋白 (VSG) 和哺乳动物 Thy-1 抗原发现的。现在已经在许多真核细胞的表面观察到,包括人类和酵母。通过使用细菌磷脂酰肌醇特异性磷脂酶 C (PI-PLC) 发现了这种键的测试,它释放了 GPI 锚定。酰胺 C 端与乙醇胺连接,乙醇胺通过磷酸二酯键进一步连接到三甘露糖基葡糖胺核心聚糖。在三甘露糖基葡糖胺核心聚糖的肌醇第 6 位,磷脂酰肌醇 (PI) 连接在双层的外部层。甘油基团可能存在许多可能的变异:烷基或酰基,并且链长也可能不同。另一个结构差异是聚糖可以具有额外的糖,一些例子是 aGal,/JGalNAc 或 aMan,以及/或磷酸乙醇胺。由于这些许多结构差异,因此这些蛋白质可以执行许多不同的功能 2。
目前只确定了四种修饰真核蛋白质的方法。然而,这并不意味着不存在其他蛋白质的脂类修饰。使用代谢标记和 SDS-PAGE 来识别受脂类调控的蛋白质,发现大约观察到 10-50 种蛋白质。这可能导致一个结论,即大约 10-50% 的蛋白质被脂类修饰。蛋白质脂类修饰的主要功能之一是定位。分析蛋白质的脂类修饰,我们可以更好地理解细胞功能2。
1. Jui-Yun Lu 和 Sandra L. Hofmann,脂类修饰蛋白的溶酶体代谢——脂类研究杂志
2. ANTHONY I. MAGEE,蛋白质的脂类修饰及其与蛋白质靶向的相关性。评论
