结构生物化学/独特性质/水的相态
外观
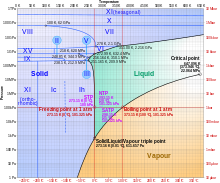
物质发生相变的温度是一个物理性质,而不是化学性质,因为它是由于分子间键的断裂和形成造成的(物质的组成不变)。为了熔化或汽化一种物质,必须输入能量来打破这些分子间键(例如氢键或范德华力)。这意味着用于熔化或汽化的能量不会导致分子更剧烈地振动或以更高的速度移动。换句话说,在相变过程中温度保持不变,如右图第三个图表所示。

请注意,汽化热远高于熔化热。这是因为只有少数氢键需要被打破才能使冰融化。每个水分子仍然保持着 3-4 个与相邻分子的氢键。另一方面,为了将液态水蒸发成水蒸气,所有氢键都必须被打破。因此,需要更多的能量输入。
H2O 可以存在于三种不同的相态:固态、液态和气态。
如右图相图所示,随着温度的升高,状态开始发生变化。冰开始融化的温度是 0°C。在室温 25°C 下,冰变成液体。最后,在 100°C 的温度下,水开始沸腾,变成蒸汽。
ΔH 值是焓,可以用将单位质量的物质从一种相态转变为另一种相态所需的能量/热量来表示。每种相态都有自己的表示符号。
固相到液相的转变焓称为熔化热。它衡量为了发生熔化,需要向系统输入多少能量。反过来,从液态到固态的转变称为凝固,凝固热的数值是熔化热的负值。
液相到气相的转变焓称为汽化热。它衡量为了发生汽化,需要向系统输入多少能量。反过来,从气态到液态的转变称为凝结,凝结热的数值是汽化热的负值。
| H2O 的 ΔH 值 | (kJ/mol) | |
|---|---|---|
| ΔH熔化 | 6.01 kJ/mol | |
| ΔH汽化 | 40.65 kJ/mol | |
| ΔH凝固 | -6.01 kJ/mol | |
| ΔH凝结 | -40.65 kJ/mol |
