普通化学/分子间键

共价键可以是极性的或非极性的,整个化合物也可能是极性的或非极性的,这取决于它的形状。当一个键是极性的,它就会产生一个偶极,即一对电荷(一个正电荷,一个负电荷)。如果它们以对称的形状排列,使得它们指向相反的方向,它们就会相互抵消。例如,由于甲烷 (CH4) 中的四个氢原子相互背离,因此没有整体偶极,该分子是非极性的。然而,在氨 (NH3) 中,由于非键合电子对引起的非对称性,氮原子上有一个负偶极。化合物的极性决定了它的分子间键合能力。
当一个分子具有线性、三角平面、四面体、三角双锥或八面体形状时,它将是非极性的。这些形状没有非键合孤对。(例如,甲烷,CH4)但如果一些键是极性的而另一些键是非极性的,将会有一个整体偶极,分子将是极性的(例如,氯仿,CHCl3)。
其他形状(有非键合对)将是极性的。(例如,水,H2O)除非,当然,所有共价键都是非极性的,在这种情况下,一开始就不会有偶极。
当两个极性分子彼此靠近时,它们将以负极和正极排列的方式排列。将存在一种吸引力将这两个分子结合在一起,但它远不如分子内键强大。这是许多类型的分子结合在一起形成大型固体或液体的方式。
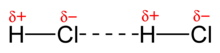
某些化学物质在其化学式中含有氢,它们具有特殊的分子间键类型,称为氢键。当氢原子连接到氧、氮或氟原子时,就会发生氢键。这是因为氢和氟、氧和氮之间存在较大的电负性差异。因此,诸如、、 是极性非常强的分子,具有非常强的偶极-偶极力。由于氟、氧和氮的高电负性,这些元素几乎完全从氢中拉走了电子。氢变成一个裸露的质子,从分子中伸出来,它将强烈地吸引任何其他极性分子的负极。氢键是偶极-偶极键的一种极端类型。这些力比分子内键弱,但比其他分子间力强得多,导致这些化合物的沸点很高。


二氧化硅形成一个共价网络。与二氧化碳(具有双键)不同,二氧化硅仅形成单共价键。因此,单个分子以共价键方式键合到一个大型网络中。这些键非常强(是共价键),并且单个分子与整个网络之间没有区别。共价网络将金刚石结合在一起。金刚石完全由碳组成,煤烟也是如此。与煤烟不同,金刚石具有共价网络,这使得它们非常坚硬且结晶。
范德华力或伦敦色散力是由电子位置不平衡时产生的临时偶极引起的。电子不断地围绕原子核运行,偶然情况下它们可能会聚集在一起。电子浓度的不均匀会导致原子的某一侧比另一侧带负电,从而产生一个临时偶极。当原子中有更多电子,并且电子层离原子核更远时,这些力会变得更强。
范德华力解释了为什么氮气可以液化。氮气是双原子的,其化学式为 N2。由于这两个原子具有相同的电负性,因此没有偶极,分子是非极性的。如果没有偶极,是什么让氮原子结合在一起形成液体呢?范德华力是答案。它们允许原本是非极性分子的分子之间存在吸引力。这些力是迄今为止将分子结合在一起的最弱的力。
在比较两种物质时,可能会问及它们的熔点和沸点。为了确定哪种物质具有更高的熔点或沸点,你必须判断哪种物质具有更强的分子间作用力。金属键、离子键和共价网络非常强,因为它们实际上是分子内作用力。这些物质具有最高的熔点和沸点,因为只有当这些强大的键断裂时,它们才会分离成单个分子。破坏这些分子内作用力需要大量的热能。
具有氢键(一种分子间作用力)的物质将具有比具有普通偶极-偶极分子内作用力的物质更高的熔点和沸点。非极性分子具有最低的熔点和沸点,因为它们由弱的范德华力结合在一起。
如果你需要比较两种金属的沸点,那么原子半径更大的金属将具有更弱的键合,因为电荷浓度较低。当比较非极性气体(如稀有气体)的沸点时,半径最大的气体将具有最高的沸点,因为它具有最大的范德华力潜力。
可以使用库仑定律比较离子化合物。寻找具有高离子电荷和低离子半径的物质。



